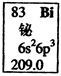- 元素
- 共40题
230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
正确答案
解析
略
知识点
元素周期表中铋元素的数据见右图,下列说法正确的是
正确答案
解析
本题考查原子结构,意在考查考生对元素周期表知识记忆的再现。由元素周期表中元素方格中各种符号、数字的意义可知Bi的质子数为83,因不知中子数,无法确定其质量数,A项错误;Bi的相对原子质量为209.0,B项正确;6p亚层有3个未成对电子,C项错误;最外层5个电子分别在s、P层,能量不同,D项错误。
知识点
人类的食物提倡低盐低糖低脂肪。化学中的盐的组成中,一定含有的元素种类是
正确答案
解析
略
知识点
氮元素可以形成多种化合物。
回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个
氮原子分别位于正四面体的4个顶点(见图2),分子内存
在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
正确答案
见解析。
解析
(1)基态氮原子的价电子排布式是2s22p3 ,学生可能审题时没注意到是价电子排布式。
(2)C、N、O三种元素第一电离能从大到小的顺序是N>O>C
(3)①NH3分子的空间构型是三角锥型,NH3中氮原子轨道的杂化类型是sp3,而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3,这个与H2O,H2O2中O的杂化类型都是sp3的道理是一样的。
②反应中有4mol N-H键断裂,即有1molN2H4参加反应,生成1.5molN2,则形成的π键有3mol。
③N2H6SO4晶体类型与硫酸铵相同,可见它是离子晶体,晶体内肯定不存在范德华力。
(4)要形成氢键,就要掌握形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F,O,N等构成的分子间形成的特殊的分子间作用力。符合这样的选项就是c和d,但题中要求形成4个氢键,氢键具有饱和性,这样只有选c。
知识点
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。
_________________________________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
正确答案
答案:(1) bc
(2)2NH3+CO2+H2O→ (NH4)2CO3
(NH4)2CO3+ CO2+H2O→2NH4HCO3
(3)①低温加压下吸收CO;②然后将铜洗液转移至另一容器中;③高温低压下释放CO,然后将铜洗液循环利用
(4)C>N>O>H ;
(5)
CS2和CO2都是分子晶体,CS2相对分子质量大,分子间作用力大。
解析
略
知识点
扫码查看完整答案与解析