- 元素
- 共40题
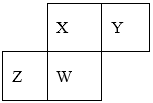
4.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,.其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
正确答案
解析
A.同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。因此这四种元素的原子半径大小关系是:Z>W>X > Y,错误。
B.元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。由于元素的非金属性:X>W>Z,所以它们的最高价氧化物对应水化物的酸性:X>W>Z,正确。
C.元素的非金属性越强,其相应的最简单的氢化物的稳定性就越强。由于元素的非金属性:Y>X>W>Z,所以元素的氢化物的稳定性:Y>X>W>Z,正确。
D.除非金属性很强的F、O元素外,一般情况下,元素原子的最外层电子数等于该元素原子的最外层电子数。X、Z、W的最高化合价分别与其主族序数相等,正确。
考查方向
解题思路
在短周期元素中,W原子的质子数是其最外层电子数的三倍,则W是15号的P元素,根据元素在周期表中的相对位置关系可确定:X是N元素,Y是O元素;Z是Si元素。
易错点
元素的推断。
知识点
12.有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍;M的单质是一种有色气体,可用于自来水的消毒;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多。下列说法正确的是
正确答案
解析
有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素,则X为Na;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍,最外层电子数为6,原子有3个电子层,则Y为S元素;M的单质是一种有色气体,可用于自来水的消毒,则M为Cl;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多,则N为Al.A.X两种常见氧化物有氧化钠、过氧化钠,氧化钠只含有离子键,过氧化钠含有离子键、共价键,故A错误;B.N与M形成的化合物为氯化铝,铝离子水解,溶液呈酸性,故B正确;C.电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:N(Al3+)<(Na+),Y(S2-)>(Cl-),故C错误;D.非金属性Y(S)<M(Cl),故气态氢化物的稳定性:Y<M,故D错误,故选:B.本题正确答案是B
考查方向
解题思路
有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素,则X为Na;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍,最外层电子数为6,原子有3个电子层,则Y为S元素;M的单质是一种有色气体,可用于自来水的消毒,则M为Cl;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多,则N为Al.
易错点
物质结构、核外电子排布与元素的性质的关系。
知识点
3.W、X、Y、Z是原子序数依次增大的短周期主族元素。W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍。下列说法正确的是()
正确答案
解析
A.分子晶体,沸点的比较看相对分子质量,相对分子质量大的,沸点就高H2O是18,NH3是17,CH4是16;四种元素的最简单气态氢化物中, H2O>NH3>CH4
B. Cl的简单阴离子不会发生水解
C.原子的半径:S>Cl>N>O
D.SO 2入BaCl2溶液中不会生成白色沉淀。
考查方向
解题思路
有X、Y、Z、W原子序数依次增大的短周期主族元素,其中W元素的气态氢化物水溶液显碱性,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,可推知X为O元素、Y为S、Z为Cl;据此解答。
易错点
分子晶体,沸点的比较看相对分子质量,相对分子质量大的,沸点就高。
知识点
10.五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
正确答案
解析
A选项,非金属性N元素大于C元素,所以该项错误;B选项,磷化氢稳定性弱于硫化氢,该选项错误;C选项,光导纤维的主要成分是二氧化硅,而Z是铝元素,所以该选项错误;D选项,硝酸的酸性大于碳酸,该选项是正确的。
考查方向
元素周期律和元素周期表
解题思路
根据题意分析可知元素X、Y、Z、M、R分别为C、N、Al、P、S,再结合元素周期律解决四个选项即可。
易错点
本题容易出现元素周期律的记忆错误。
知识点
10.根据元素周期律,由下列事实进行归纳推测,推测不合理的是
正确答案
B
解析
A、Mg、Ca与Ba均属于第ⅡA族,金属性依次增强,与水反应的剧烈程度也变大,正确;
B、半导体是指金属与非金属的交界线处,而不是第ⅣA族的元素,错误;
C、Cl、Br、I均为第ⅦA族元素,非金属性依次减弱,气态氢化物的稳定性依次减弱,正确;
D、Si、P、S为同一周期元素,非金属性依次增大,与氢气反应应依次更加容易,则条件逐渐变得容易,正确;所以答案为B。
考查方向
解题思路
高中化学里 这里的元素性质主要体现在三个方面:
1、金属性与非金属性
越靠左下侧的元素金属性越强,非金属性越弱;越靠右上侧的元素非金属性越强,金属性越弱。
2、原子半径
同周期元素,越靠右的原子半径越小;同族元素,越靠下的原子半径越大。
3、化合价
主族元素化合价=元素所在主族族序数=最外层电子数=价电子数。物理性质(例如熔沸点)是不可以从元素周期表上直接得出结论的。
易错点
1、元素的金属性和非金属性随与原子序数呈现周期性变化。
知识点
扫码查看完整答案与解析