- 化学常用计量
- 共355题
1.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于
正确答案
解析
A第116号元素Lv的原子序数为116,故A正确; B ,中子数=质量数﹣质子数=293﹣116=177,故B正确;C,原子序数=质子数=核外电子数=核电荷数,可知核外电子数为116,故C正确;D,293代表该原子的质量数,一种元素有多种核素,质量数指的是质子与中子质量的和,不同核素的质量数不同,即一种元素可以有多个质量数,相对原子质量为各核素的平均相对质量,所以同种元素的相对原子质量只有一个数值,两者近似相等,故D错误.故选D.
考查方向
解题思路
根据在原子中:原子序数=质子数=核外电子数=核电荷数,进行解答.
易错点
本题主要考查了原子符号的含义,掌握原子序数=核内质子数=核电荷数是解题的关键,题目难度不大.
知识点
29.下图是化学实验中常见的几种装置(可以重复选择,必要时可加热,加热所需的有关仪器已省略)
I.若要收集一瓶纯净干燥的氯气。
(1)写出烧瓶中发生反应的离子方程式( )。
(2)所需选择装置的连接顺序是( )(填导管口字母编号)。
(3)下列是某同学实验过程中的部分操作,进行的顺序由先剑后的是____(填序号)。
①打开A中分液漏斗的活塞,往A中加入足量的试剂;②检查装置的气密性;
③点燃酒精灯; ④装入药品;⑤熄火酒精灯;⑥关闭A中分液漏斗的活塞。
(4)将收集的氯气通入紫色石蕊试液中,试液的颜色变化如下,请在括号内填写出导致该阶段颜色变化的粒子的化学符号:
Ⅱ.若按A、E、B、D的顺序连接四个装置,收集一瓶干燥的氨气。
(1)装置E盛装的试剂是( ) 。
(2)装置D的作用是( )。
(3)装置E和装置B连接的导管依序是____(填导管口字母编号,下同)和( )。
Ⅲ.某同学把产生氯气和氨气的导管分别与装置F中的h、i相连,发现装置F中产生大量白烟、观察装置F的特点,结合我们学习过的知识分析,装置F中发生反应的化学方程式是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.NH4Cl稀溶液中分别加入少量下列物质或改变如下条件,能使比值c(NH4+)/c(Cl—
①HCl气体
②氨气
③H2O
④NH4Cl固体
⑤NaOH固体
⑥降温
正确答案
解析
①HCl气体能抑制NH4+的水解,导致水溶液中NH4+浓度增大,但是同时Cl—浓度增大,且平衡移动过程中NH4+浓度会有所减小,由此可见两种离子浓度都增大,但Cl—浓度增大的程度更大
②氨气 能直接促使溶液中NH4+浓度增大,Cl—浓度基本不变
③H2O 对原溶液起到稀释作用,但由于稀释能促进水解,导致NH4+浓度减小的程度更大④NH4Cl固体 能同时增大两种离子的浓度,但是由于NH4+浓度的增大能促进水解,导致Cl—浓度增大的程度稍小于Cl—浓度增大的程度
⑤NaOH固体 能促进水解,导致NH4+减小⑥降温抑制NH4+水解,从而使得NH4+浓度增大。综上所述答案为D
考查方向
本题考查电解质在溶液中的存在形式
解题思路
本题需要考虑盐类物质在水中发生的水解,且对于盐类水解影响因素熟练掌握并加以判断。既是对勒夏特列原理的理解和应用
易错点
本题需要注意强酸弱碱盐在水溶液时会发生水解,而且盐类的水解是一种极弱的可逆平衡过程,考生通常容易忽略水解过程以及对影响盐类水解的因素判断出现混淆
知识点
17.分类法是研究物质的一种重要方法。现有以下4种物质:①氯气、②氢氧化钠、③氯化铝、④氧化钙,其中属于电解质的是_______(填序号,下同),属于离子化合物的是_________,溶于水的过程中能与水发生化学反应的是__________。
正确答案
②③④;②④;①③④
解析
①氯气是单质不是电解质,溶于水发生如下反应Cl2+H2O=HCl+HClO:不是离子化合物;
②熔融的氢氧化钠存在自由离子,是电解质能导电;溶于水只发生电离,不发生化学反应,是离子化合物;
③氯化铝溶于水发生电离不发生化学反应,有能够导电的离子,是电解质,是离子化合物;
④熔的氧化钙存在融自由离子,是电解质能导电,溶于水发生如下反应CaO+H2O=Ca(OH)2;是离子化合物,
综上所述:属于电解质的是②③④;属于离子化合物的是②④;溶于水的过程中能与水发生化学反应的是①③④
故答案为:②③④;②④;①③④。
考查方向
解题思路
电解质是水溶液中或熔融状态下导电的化合物;离子化合物由阳离子和阴离子构成的化合物。
易错点
不能准确把握电解质、离子化合物的概念以及实质。
知识点
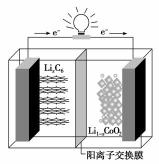
18.某种聚合物锂离子电池放电时的反应为Li1-xCoO2+LixC6=6C+LiCoO2,其电池如图所示。下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
在常压和500℃条件下,等物质的量的Ag2O、Fe(OH)3、NH4HCO3、NaHCO3完全分解,所得气体体积依次为V1、V2、V3、V4,体积大小顺序正确的是
正确答案
解析
常压和500℃条件下,水是气体,等物质的量的Ag2O,Fe(OH)3 ,NH4HCO3 ,NaHCO3完全分解,根据分解化学方程式可知:生成的气体体积大小顺序为V3>V4>V2>V1。
知识点
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100ml溶液A 。②准确量取25.00 ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g 。③准确量取25.00 ml溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 ml。H2O2与KMnO4反应的离子方程式如下:
2MnO4―+5H2O2+6H+=4Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(2)上述滴定不加稀硫酸酸化,MnO4―被还原成MnO2,其离子方程式为:
。
(3)通过计算确定样品的组成(写出计算过程)。
正确答案
见解析。
解析
(1)n(BaSO4)=0.5825g/233 g·mol-1=2.50×10-3 mol
(2)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(3)n(H2O2)=5/2·(0.0200mol· L-1×25.00 mL)/1000mL· L-1=1.25×10-3 mol
m(Na2SO4)=142g·mol-1×2.50×10-3mol=0.355g
m(H2O2)=34g·mol-1×1.25×10-3mol=0.0425g
n(H2O)=[(1.7700g×25.00mL/100 mL)-0.355g-0.0425g]/18 g·mol-1
=2.5×10-3 mol
x:y:z=n(Na2SO4):n(H2O2):n(H2O)=2:1:2
硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O
本题属于物质组成分析与化学综合计算题。利用氧化还原反应滴定进行成分析,运用元素守恒进行推理计算,兼有溶度积常计算,离子方程式书写。
知识点
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①Cu0未完全起反应
② CuO不干燥
③Cu0中混有不反应的杂质
④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_____________,或_______________和_______________达到实验目的。
正确答案
(1)2NH3+3CuO
(2)a→e→b→e
(3)
(4)①③
(5)m(CuO)和m(Cu)、m(Cu)和m(H2O)
解析
本题主要考察氨气的制备、净化、干燥和利用方程式进行的计算以及有关误差分析。氨气具有弱还原性,在加入条件下可以被氧化铜氧化,反应的化学方程式为:
2NH3+3CuO




知识点
8.下列叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
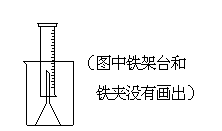
26.测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数及物质的量分数。现有下列实验用品:中学化学实验常用仪器、1000 mL烧杯、100 mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19 g·cm-3)、水。
按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100 mL)
(1).补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在1000 mL烧杯底部,把短颈漏斗倒扣在样品上面。
②_________________________________▲________________________________________。
③_________________________________▲________________________________________。
④_________________________________▲________________________________________。
(2).合金样品用铜网包裹的目的是什么?
___________________________________▲_____________________________________。
(3).已知一定质量的铝锌合金的总物质的量为n,实验测得的气体体积为V1mL(已经换算为标准状况)。则铝锌合金中铝的物质的量分数为:_______▲__________。(用含n和V1的式子表示)
(4)本装置也可用于测定金属锌(或其它金属)的相对原子质量,若m g金属锌进行实验,测得的气体体积为V2mL(已经换算为标准状况)。则金属锌的相对原子质量为:________▲_________。(用含m和V2的式子表示)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析