- 常见的能量转化形式
- 共45题
4.分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
正确答案
解析
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,属于饱和一元酯,
若为甲酸和丁醇酯化,甲酸只有1种,丁醇有4种;
若为乙酸和丙醇酯化,乙酸只有1种,丙醇有2种;
若为丙酸和乙醇酯化,丙酸只有1种,乙醇只有1种;
若为丁酸和甲醇酯化,丁酸有2种,甲醇只有1种;
故羧酸共有5种,醇共有8种,酸和醇重新组合可形成的酯共有5×8=40种,
故选D.
考查方向
解题思路
分子式为C5H10O2的酯为饱和一元酯,形成酯的羧酸与醇的碳原子总数为5,讨论羧酸与醇含有的碳原子,判断形成该酯的羧酸与醇的同分异构体种数,根据羧酸与醇组合,计算同分异构体数目
易错点
形成酯的羧酸与醇的同分异构体的判断
知识点
17.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是
正确答案
解析
A、因为通入惰性气体,体积增大导致反应物和生成物的浓度均减小,因此反应速率减小,A正确;
B、利用三段式,可得CO2的转化率为25.0%,B正确,
C、由图可知T℃时,平衡体系中CO2和CO体积分数相等,则在恒压密闭容器中再充入等体积的CO2和CO,平衡不移动,C错误;
D、平衡后P(CO)=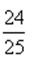
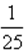
考查方向
解题思路
准确分析图形,根据图形变化规律联系平衡移动原理相关结论进行验证
易错点
影响化学反隐速率的因素以及平衡移动原理
知识点
7.已知常温下Ksp(AgCl)=1.6×10-10、Ksp(AgI)=2.0×10-16,下列说法中正确的是( )
正确答案
解析
A根据溶解平衡可知,含有大量Cl-的溶液中一定哈有银离子,所以A错误;
B碘化银悬浊液中加入少量的KI粉末,平衡AgI(s)
C.AgCl悬浊液中逐渐加入KI固体至c(I-)=Ksp(AgI)/ 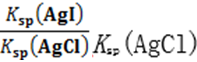
D.向浓度均为0.01 mol·L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中银离子的浓度为1.6×10-8mol·L-1溶液中I-的浓度为2.0×10-8 /1.6×10-8 mol·L-1=1.25×10-8mol·L-1
考查方向
解题思路
1、对于沉淀溶解平衡:AmBn(s) mAn+(aq)+nBm-(aq),Ksp=cm(An+)·cn(Bm-),对于相同类型的物质,Ksp的大小反映了难溶电解质在溶液中溶解能力的大小,也反映了该物质在溶液中沉淀的难易。与平衡常数一样,Ksp与温度有关。不过温度改变不大时,Ksp变化也不大,常温下的计算可不考虑温度的影响。
2、向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但Ksp不变。
易错点
1、AgI悬浊液中加入少量KI粉末,平衡向溶解方向移动。
2、Ksp的计算。
知识点
草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。查阅资料得知:
(1)易溶于乙醇和水,微溶于乙醚(易挥发),难溶于苯和四氯化碳。
(2)草酸具有很强的还原性
请跟据以上信息回答下列问题:
19.氧化—水解过程是在上图1的装置中进行的,指出装置A的名称 。
20.氧化—水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸产率的影响,结果如上图2所示,请选择最佳的反应温度为 ,实验中若混酸滴加过快或温度过高,将导致草酸产率下降,其原因是 .
21.得到粗产品后,洗涤时选择 作洗涤剂,理由是 。
22.为了确定产品中H2C2O4·2H2O(M=126g/mol)的纯度,称取10.0g草酸样品,配成250mL溶液,每次实验时准确量取25.00mL草酸溶液,加入适量的稀硫酸,用0.1mol/LKMnO4标准溶液滴定.平行滴定三次,重复滴定三次,每次消耗KMnO4标准溶液的体积如下表所示
①写出滴定过程中的离子方程式 。
②在草酸纯度测定的实验过程中,下列说法正确的是: 。
A. 配制标准液时,若KMnO4不纯(杂质不与待测液反应),会使实验误差偏低
B. 润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
C.滴定时,眼睛注视锥形瓶,观察溶液颜色变化
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是: 。
④草酸晶体的纯度为 。
正确答案
三颈烧瓶
解析
仪器名称:三颈烧瓶。
考查方向
解题思路
本题考查了探究物质的组成、测量物质的含量的方法,题目难度较大,注意掌握探究物质组成及含量的方法,明确常见化学实验基本操作方法,正确理解题干信息及生成流程为解答本题的关键.
(1)根据纤维素水解过程中需要硫酸做催化剂分析;根据图1、图2中草酸收率判断硫酸的最佳浓度及最佳浸泡时间;
(2)根据滴定管的使用方法、草酸与高锰酸钾溶液的反应方程式进行判断.
易错点
1、根据图1、图2中草酸收率判断硫酸的最佳浓度及最佳浸泡时间;
2、滴定计算。
正确答案
70℃;草酸易被浓硫酸或硝酸氧化
解析
甘蔗渣的主要成分为纤维素,图①加入硫酸的目的是使纤维素水解,硫酸起到了催化作用;根据图2可知,浓硫酸质量分数从60%到70%,草酸收率逐渐升高,当硫酸质量分数从70%到80%,草酸收率反而降低,所以硫酸质量分数为70%时草酸收率最高,且甘蔗浸泡效果最佳;
考查方向
解题思路
本题考查了探究物质的组成、测量物质的含量的方法,题目难度较大,注意掌握探究物质组成及含量的方法,明确常见化学实验基本操作方法,正确理解题干信息及生成流程为解答本题的关键.
(1)根据纤维素水解过程中需要硫酸做催化剂分析;根据图1、图2中草酸收率判断硫酸的最佳浓度及最佳浸泡时间;
(2)根据滴定管的使用方法、草酸与高锰酸钾溶液的反应方程式进行判断.
易错点
1、根据图1、图2中草酸收率判断硫酸的最佳浓度及最佳浸泡时间;
2、滴定计算。
正确答案
乙醚,易挥发,无残留.
解析
得到粗产品后,洗涤时选择易挥发,无残留乙醚作洗涤剂,防止产生提取的产品纯度不高。
考查方向
解题思路
本题考查了探究物质的组成、测量物质的含量的方法,题目难度较大,注意掌握探究物质组成及含量的方法,明确常见化学实验基本操作方法,正确理解题干信息及生成流程为解答本题的关键.
(1)根据纤维素水解过程中需要硫酸做催化剂分析;根据图1、图2中草酸收率判断硫酸的最佳浓度及最佳浸泡时间;
(2)根据滴定管的使用方法、草酸与高锰酸钾溶液的反应方程式进行判断.
易错点
1、根据图1、图2中草酸收率判断硫酸的最佳浓度及最佳浸泡时间;
2、滴定计算。
正确答案
⑷5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O ②CD③向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色 ④50.4%
解析
①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,蒸馏水不影待测液的量,对V(标准)无影响,根据
考查方向
解题思路
本题考查了探究物质的组成、测量物质的含量的方法,题目难度较大,注意掌握探究物质组成及含量的方法,明确常见化学实验基本操作方法,正确理解题干信息及生成流程为解答本题的关键.
(1)根据纤维素水解过程中需要硫酸做催化剂分析;根据图1、图2中草酸收率判断硫酸的最佳浓度及最佳浸泡时间;
(2)根据滴定管的使用方法、草酸与高锰酸钾溶液的反应方程式进行判断.
易错点
1、根据图1、图2中草酸收率判断硫酸的最佳浓度及最佳浸泡时间;
2、滴定计算。
12.某实验小组为测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量Wg样品进行实验,下列实验方法所对应的实验方案和测量数据最合理的是
正确答案
A
解析
B中碱石灰也吸收CO2中含有的水蒸气,不正确;CO2挥发会带出水蒸气,C不正确CO2能溶于水,所以不能排水法收集,因此正确的答案选A。
考查方向
解题思路
利用碳酸钠和盐酸能反应放出二氧化碳,而氯化钠不反应这一原理即可。
易错点
常见基本实验方法及其原理
知识点
扫码查看完整答案与解析