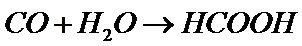- 常见的能量转化形式
- 共45题
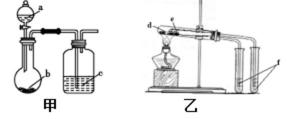
2.下列叙述正确的是( )
①装置甲可防止铁钉生锈 ②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性 ④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
正确答案
解析
①在装置中,金属Fe做电解池的阳极,电极本身失电子,更易生锈,故①错误;
②高锰酸钾具有氧化性,可以将乙烯氧化为二氧化碳,带入了新的杂质二氧化碳,故②错误;
③氯化氢极易溶于水,挤压胶头滴管,则集气瓶中压强减小,所以气球鼓起来,可以使用该装置验证HCl气体在水中的溶解性,故③正确;
④乙酸乙酯可以用饱和碳酸钠来吸收,不能用氢氧化钠,乙酸乙酯在氢氧化钠中水解,故④错误;
⑤装置可以收集气体,当集气瓶来用,导管长进短出时,可以收集密度大于空气的气体,如:CO2、Cl2、HCl、NO2等气体,如果当洗气瓶,导管应长进短出,故⑤正确。
故选C。
考查方向
解题思路
①金属做电解池的阳极时,更易被腐蚀;
②高锰酸钾具有氧化性,可以将乙烯以及乙炔氧化为二氧化碳;
③氯化氢极易溶于水,根据大气压强原理来分析;
④乙酸乙酯可以用饱和碳酸钠来吸收;
⑤装置可以收集气体,当集气瓶来用,也可以当洗气瓶,但是要注意导管的连接情况。
易错点
本题考查较为综合,涉及化学原电池、物质的制备、性质以及气体收集等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大
知识点
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
Ⅰ.2NO2(g)+NaCl(g)
Ⅱ.2NO(g)+Cl2(g)
请回答下列问题:
13.4NO2(g)+2NaCl(g)
14.若反应Ⅰ在绝热密闭容器中进行,实验测得NO2(g)的转化率随时间变化如图所示,t3~t4时刻NO2(g)的转化率(NO2%)降低的原因是____________。
15.若反因Ⅱ在恒温、恒容条件下进行,下列能判断该反应一定达到平衡状态的是__________。
A.容器内压强不再变化
B.n(ClNO)=n(NO)
C.混合气体密度不变
D.v正(NO)=v逆(ClNO)
16.在一定温度和压强下,反应Ⅱ达到平衡,当NO和Cl2的比例不同时,对Cl2的转化率及平衡混合物中ClNO的体积分数都有影响。设NO和Cl2起始物质的量之比为x,平衡时Cl2的转化率为a,平衡混合物中ClNO的体积分数为y,y=_______。(用a和x的代数式表示y)
17.实验室用NaOH溶液吸收NO2,反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol/L CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)、c(CH3COO-)由大到小的顺序______。(已知HNO2的电离常数K3=7.1×10-4 mol/L,CH3COOH的电离常数K4=1.7×10-5mol/L)。常温下,向溶液B中加水稀释过程中,下列比值变大的是_______。
a.c(H+)/c(OH-)
b.c(OH-)/c(CH3COO-)
c.c(Na+)/c(CH3COO-)
d.c(CH3COO-)·c(H+)/c(CH3COOH)
正确答案
2ΔH1—ΔH2
K12/K2
解析
①方程式4NO2(g)+2NaCl(g)
②由方程式I得:
由方程式II得:
而所求方程式的平衡常数
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
正确答案
因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低。
解析
若反应Ⅰ:2NO2(g)+NaCl(g)
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
易错点
转化率降低的解释
正确答案
AD
解析
若反因Ⅱ:2NO(g)+Cl2(g)
故A.容器内压强不再变化——是平衡标志之一;平衡状态定义所得标志有二,其一是正逆反应速率相等,故D.v正(NO)=v逆(ClNO)——是平衡标志之二(且二者的计量数之比刚好是1:1);其二是各成分的浓度保持不变,而不是物质的量相等,
故B.n(ClNO)=n(NO)——不能作为平衡标志;
C.混合气体密度不变 ——因容器体积一定、且气体反应前后质量守恒,故密度是个不变量,不能作为平衡标志。
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
正确答案
y=2a/(x+1-a)
解析
在一定温度和压强下,反应Ⅱ达到平衡,……。设NO和Cl2起始物质的量之比为x,则n(Cl2)=1 mol时,n(NO)=x,若平衡时Cl2的转化率为a,则有:
2NO(g)+Cl2(g)
始量/mol x 1 0
变量/mol 2a a 2a
平量/mol x-2a 1-a 2a
故平衡混合物中ClNO的体积分数为y=2a/[(x-2a)+(1-a)+2a] =2a/(x+1-a)
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
正确答案
c(NO3-)>c(NO2-)>c(CH3COO-) a b c
解析
有反应:2NO2+2NaOH=NaNO3+NaNO2+H2O知,含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A——即0.1 mol/L NaNO3和0.1 mol/L NaNO2;溶液B为0.1mol/L CH3COONa溶液。
又已知HNO2的电离常数K3=7.1×10-4 mol/L,CH3COOH的电离常数K4=1.7×10-5mol/L。可得:HNO2的酸性强于CH3COOH,则CH3COONa的水解能力强于NaNO2,NaNO3不水解。因此,同浓度的两溶液中c(NO3-)、c(NO2-)、c(CH3COO-)由大到小的顺序是:
c(NO3-)>c(NO2-)>c(CH3COO-)。
常温下,向溶液B中——即CH3COONa溶液加水稀释过程中,水解程度增大,溶液中n(CH3COO-)减少、c(CH3COO-)也减少;n(CH3COOH)增大、但因水量增大而使c(CH3COOH)降低;n(OH-)增大、但也因水量增大而c(OH-)降低,此时相反的是c(H+)则增大。故:
a.c(H+)/c(OH-) 比值变大;
b.c(OH-)/c(CH3COO-)= n(OH-)/ n(CH3COO-),比值也变大;
c.c(Na+)/c(CH3COO-)= n(Na+)/n(CH3COO-),比值也变大;
d.c(CH3COO-)·c(H+)/c(CH3COOH)= K4=1.7×10-5mol/L,不变。
考查方向
解题思路
依据化学方程式叠加法、化学平衡原理、水解规律及守恒原理解题。
易错点
两溶液中离子浓度大小比较
将猫薄荷中分离出的荆芥内酯与等物质的量的氢气进行加成,得到的二氢荆芥内酯是
一种有效的驱虫剂,可用于商业生产。下图为二氢荆芥内酯的一种合成路线:
已知:A(C10H16O)的结构中有一个五元环,能发生银镜反应。回答下列问题:
20.由D生成二氢荆芥内酯的化学方程式为 _______________________ 。
21.D在某催化剂作用下可发生反应生成一种高聚物,其结构简式为 ______ ,
22.写出符合以下条件的荆芥内酯的同分异构体的结构简式_______________ ,
①结构中含有苯环 ②只有一个侧链 ③能发生酯化反应 ④不能发生消去反应
其分子中最多有 个碳原子在同一平面上。
23. 已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮。完成下列合成
内酯路线:
正确答案

解析
A的分子式为C10H16O,不饱和度为






由D生成二氢荆芥内酯的化学方程式为:

考查方向
解题思路
A的分子式为C10H16O,不饱和度为 







易错点
有机物的推断与合成线的设计、已知信息的应用、官能团的性质和反应类型。
正确答案
解析
A的分子式为C10H16O,不饱和度为






D再浓硫酸条件下缩聚反应得到高聚物E为
考查方向
解题思路
A的分子式为C10H16O,不饱和度为 







易错点
有机物的推断与合成线的设计、已知信息的应用、官能团的性质和反应类型。
正确答案

解析
A的分子式为C10H16O,不饱和度为






符合以下条件的二氢荆芥内酯的同分异构体:①结构中含有苯环,则侧链没有不饱和键; ②只有一个侧链,③能发生酯化反应,含有羟基,④不能发生消去反应,该同分异构体结构简式为:

考查方向
解题思路
A的分子式为C10H16O,不饱和度为 







易错点
有机物的推断与合成线的设计、已知信息的应用、官能团的性质和反应类型。
正确答案
解析
A的分子式为C10H16O,不饱和度为






已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮。完成下列合成内酯
据官能团的性质,对二甲苯




故答案为:
考查方向
解题思路
A的分子式为C10H16O,不饱和度为 







易错点
有机物的推断与合成线的设计、已知信息的应用、官能团的性质和反应类型。
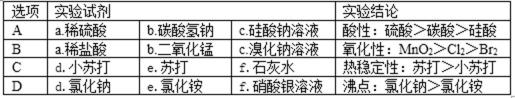
6.用下图所示装置进行实验,能得出相应实验结论的是( )
甲 乙
正确答案
解析
:A..强酸能弱酸盐反应生成弱酸,根据强酸制取弱酸判断酸性强弱,稀硫酸和碳酸氢钠反应生成二氧化碳,二氧化碳、水和硅酸钠反应生成难溶性硅酸,看到的现象是烧瓶中有气体生成、c中有沉淀生成,所以可以实现实验目的,故A正确;B.稀盐酸和二氧化锰不反应,浓盐酸和二氧化锰在加热条件下反应生成氯气,所以不能得到氯气,不能实现实验目的,故B错误;C.碳酸钠热稳定性较强,碳酸氢钠不稳定,受热易分解,所以d为碳酸钠、e为碳酸氢钠,故C错误;D.氯化铵不稳定受热易分解,所以该装置不能实现实验目的,故D错误;
考查方向
解题思路
A.强酸能弱酸盐反应生成弱酸,根据强酸制取弱酸判断酸性强弱;
B.稀盐酸和二氧化锰不反应,浓盐酸和二氧化锰在加热条件下反应生成氯气;
C.碳酸钠热稳定性较强,碳酸氢钠不稳定,受热易分解;
D.氯化铵不稳定受热易分解.
易错点
对反应装置即实验过程和实验结论认识不清
知识点
7.加热HCOONa固体,发生的反应有( )
HCOONa加热分解时,固体失重率与温度的关系如下图所示。下列说法正确的是( )
正确答案
解析
A.加热完全分解得到Na2C2O4时,失重率为2/136×100%≈1.47%<5%,则T<415℃时反应①、②同时发生,故B错误;B.由A中分析可知,反应①、②可能同时发生,故B错误;C.加热分解完全残留固体为Na2CO3,失重率为30/136×100%≈22.1%,则570℃<T<600℃时,残留固体的主要成分是Na2CO3,故C正确;D.残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率,故D错误.
考查方向
解题思路
加热分解完全残留固体为Na2CO3,失重率为30/136×100%≈22.1%,则570℃<T时残留固体的主要成分是Na2CO3,完全分解得到Na2C2O4时,失重率为2/136×100%≈1.47%,则T<415℃时反应①、②同时发生,残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率.
易错点
对图像的分析不到位
知识点
15.下列对相关实验操作的说法中,一定正确的是
正确答案
解析
A.配制480 mL 0.1 mol/L NaOH溶液,选择500mL容量瓶,NaOH的质量m=nVM=0.5L×0.1mol/L×40g/mol=2.0g,故A错误;
B.在硫酸铜结晶水含量的测定实验中,实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.1 g为止,一般情况下,结晶水含量测定时称量次数不得少于4次,故B正确;
C.中和滴定实验中氢离子的物质的量与氢氧根离子的物质的量相等,则可以利用标准液滴定待测液,也可利用待测液滴定标准液,故C错误;
D.分液时,避免上下层液体混合,则分液漏斗中下层液体从下口放出后,上层液体从上口倒出,故D错误;
考查方向
物质的分离、提纯的基本方法选择与应用
解题思路
A.配制480 mL 0.1 mol/L NaOH溶液,选择500mL容量瓶,结合m=nVM计算;
B.实验测定加热前后固体的质量,且直至连续两次称量的差不超过0.1 g为止;
C.中和滴定实验中氢离子的物质的量与氢氧根离子的物质的量相等;
D.分液时,避免上下层液体混合
易错点
B项硫酸铜晶体中结晶水含量测定实验的质量称量次数
教师点评
本题考查化学实验方案的评价,把握溶液配制、结晶水测定实验、中和滴定及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大
知识点
13.向等物质的量浓度的Ba(OH)2 与Ba

式与事实相符的是( )
正确答案
解析
A.等物质的量浓度的Ba(OH)2与BaCl2的混合溶液中加入NaHCO3溶液,反应生成碳酸根离子,碳酸根离子与钡离子不共存,一定会产生沉淀,故A错误;
B.Ba2++OH-+HCO3-→BaCO3↓+H2O可以表示1mol氢氧化钡与1mol氯化钡,1mol碳酸氢钠的离子反应,故B正确;
C.若氢氧化钡物质的量为1mol,则氯化钡物质的量为1mol,加入碳酸氢钠,消耗2mol氢氧根离子生成2mol碳酸根离子,2mol碳酸根离子能够与2mol钡离子反应生成2mol碳酸钡沉淀,故C错误;
D.依据方程式可知:3molOH-对应对应1.5mol氢氧化钡,则氯化钡物质的量为1.5mol,消耗3mol碳酸氢根离子,能够生成3mol碳酸根离子,同时生成3mol碳酸钡沉淀,故D错误;
考查方向
离子方程式
解题思路
氢氧化钡、氯化钡中加入碳酸氢钠,碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水,生成的碳酸根离子再与钡离子反应生成碳酸钡沉淀,据此分析
易错点
离子反应的顺序
教师点评
本题考查了离子方程式的书写,侧重考查反应物用量不同的离子反应方程式的书写,明确离子反应的顺序是解题关键,题目难度较大
知识点
18.目前工业上多用CO制备甲酸,其主要过程如下:
流程一:
流程二:
下列说法正确的是
正确答案
解析
A.反应物全部得到生成物,原子利用率均为100%,故A正确;
B.甲酸钠和甲酸都易溶于水,不能用洗涤液分液法,故B错误;
C.④水解生成的甲醇能循环利用,利用率更高,故C正确;
D.流程一为2CO+2NaOH+H2SO4=Na2SO4+2HCOOH,流程二为CO+H2O→HCOOH,故D错误
考查方向
化学实验方案的评价
解题思路
A.反应物全部得到生成物;
B.甲酸钠和甲酸都易溶于水;
C.④水解生成的甲醇能循环利用;
D.流程一为2CO+2NaOH+H2SO4=Na2SO4+2HCOOH
易错点
工艺流程的优化比较
教师点评
本题考查化学实验方案评价,涉及实验流程分析等,把握反应原理为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大
知识点
11.不同的金属在冶炼方法上也有所不同,下列说法正确的是
正确答案
解析
A.钒、铬、锰可用铝热反应制取,铁用热还原法炼制,故A错误;
B.炼铁和炼钢都是利用氧化还原反应的原理,不同点是前者使用还原剂,后者使用氧化剂,故B错误;
C.氯化铝是共价化合物,所以熔融时,它是不导电的,工业上用电解氧化铝方法制取铝,故C错误;
D.高炉炼铁中焦炭的作用为与氧气反应产生热量和制造还原剂一氧化碳,故D正确
考查方向
金属冶炼
解题思路
A.铁通常用热还原发制取;
B.依据炼铁和炼钢原理解答;
C.工业上采用电解熔融氯化物的方式制取钠、镁,用电解氧化铝来制取铝;
D.依据炼铁原理解答
易错点
炼钢和炼铁的原理区别
教师点评
本题考查了金属的冶炼方法选择,明确金属活泼性是解题关键,注意氯化铝为共价化合物,不导电,冶炼金属铝通常用电解熔融氧化铝方法,题目难度中等
知识点
关于大宗和关键原材料的供应,应调查主要供应企业的生产经营情况,并在( )阶段签订供货意向书。
A.初步可行性研究
B.可行性研究
C.项目评估
D.项目决策审批
正确答案
B
解析
大宗和关键原材料的供应,应调查主要供应企业的生产经营情况,并在可行性研究阶段签订供货意向书。
扫码查看完整答案与解析