- 化学平衡建立的过程
- 共29题
19.向100mL0.1mol·L–1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol·L—1Ba(OH)2溶液。随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示。下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.电解原理在化学工业上有着广泛的应用,按下图所示所示装置进行电解实验。A.B.C.D均为惰性电极,开始电解前在甲装置的A.B极两侧各滴入酚酞试液。工作一段时间后:
(1)A极附近可观察到的现象是________________________;
检验B电极上反应产物的通常方法是_____________;
甲电池中电解反应的离子方程式是 ________________________;
溶液中还可能存在的离子反应方程式是 ____________________________。
(2)甲槽溶液的pH________(填“增大”.“不变”或 “减小”,下同);乙槽溶液的pH________。当A极上收集到22.4L气体(标准状况)时,乙装置的C极上可得到______g金属单质。
利用A.D两极上析出的物质制成的燃料电池,是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答(3)~(6):
(3)氢氧燃料电池的能量转化主要形式是_______,在导线中电子流动方向为_______(用a.b 表示)。
(4)负极反应式为____________。
(5)电极表面镀铂粉的原因为__________
(6)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
①反应Ⅰ中的还原剂是_______,反应Ⅱ中的氧化剂是_______。
②先用锂吸收224L(标准状况)H2,将生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为_______mol。
正确答案
(1)有无色无味的气体产生,溶液由无色变浅红色
将湿润的淀粉KI试纸放在B极附近,试纸变蓝
(2)增大 减小 64
(3)由化学能转化为电能 由a到b
(4)
(5) 增大电极单位面积吸附H2、O2的分子数,加速电极反应速率
(6) ①Li H2O ② 32
解析
解析已在路上飞奔,马上就到!
知识点
6.已知:(HF)2(g) 
正确答案
解析
A.由题给信息知该反应为气体分子数增大的吸热反应,从图像可以看出,当压强不变时,由T1到T2,
B.由于T1温度较高,升高温度平衡右移,故温度为T1时的平衡常数大于温度为T1时的平衡常数,再结合温度不变平衡常数不变知,K(b)>K(a)=K(c),B错误;
C.温度越高,反应速率越大,压强越大,反应速率越大,故vb>va,C正确;
D.设HF为xmol,(HF)2为ymol,当

故选C。
考查方向
解题思路
A.由题给信息知该反应为气体分子数增大的吸热反应,从图像可以看出,当压强不变时,由T1到T2,
B.由于T1温度较高,升高温度平衡右移,故温度为T1时的平衡常数大于温度为T1时的平衡常数,再结合温度不变平衡常数不变知,K(b)>K(a)=K(c);
C.温度越高,反应速率越大,压强越大,反应速率越大,故vb>va;
D.设HF为xmol,(HF)2为ymol,当

易错点
本题解题的关键是掌握热化学方程式的化学计量数仅表示物质的物质的量,不表示体积、分子个数等等。
知识点
8. 下列叙述I和II均正确且具有因果关系的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3
反应② [O]+O3
总反应:2O3
(1)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(2)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A,40°C、pH=3.0
B,10°C、pH=4.0
C,30°C、pH=7.0
(3)下列叙述正确的是
A,降低温度,K增大
B,K=K1+K2
C,适当升温,可提高消毒效率
D,压强增大,K2减小
正确答案
(1)1×10-4
(2)B<A<C
(3)AC
解析
略
知识点
一定条件下,通过下列反应可以制备特种陶瓷的原料
正确答案
解析
该反应为正方向体积增加且吸热。A、升高温度,平衡正向移动,气体的质量增加,密度增大,正确;B、增加co的量,平衡正向移动,但压强增大,转化的量,没有上一平衡多,故比值减小,错误;C、平衡常数只与温度有关,错误;D因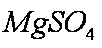
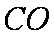
知识点
合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示。
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为 。
(2)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来。运用化学平衡的
知识分析这样做的是否有利于氨的合成
(3)右图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
①若分别用υA(NH3)和υB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则υA(NH3) υB(NH3)(填“>”、“<”或“=”)。
②在相同温度、当压强由p1变为p3时,合成氨
反应的化学平衡常数 。(填“变大”、“变小”或“不变”)。
③在250℃、1.0×104 kPa下,H2的转化率为 %(计算结果保留小数点后
1位)。
(4)NH3(g) 与CO2(g) 经过两步反应生成尿素,
NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为 。
(5)运输氨时,不能使用铜及其合金制造的管道阀门。因为,在潮湿的环境中,金属
铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,该反应的离子方程
式为 。
正确答案
见解析。
解析
(1)
(2)移走氨气,减小生成物浓度,平衡右移,有利于氨生成
(3)① <
② 不变
③ 66.7%
(4)2NH3(g) + CO2(g) === CO(NH2)2(s) + H2O(l) △H = -134 kJ/mol
(5)2Cu + 8NH3 + O2 + 2H2O === 2Cu(NH3)42+ + 4OH-
知识点
邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一:
试回答下列问题:
(1)化合物Ⅰ的名称是 ;化合物II→化合物III 的有机反应类型: ;
(2)化合物III 在银氨溶液中发生反应化学方程式: ;
(3)有机物 X 为化合物IV的同分异构体,且知有机物X 有如下特点:
①苯环上的氢有两种,②能与NaHCO3 反应放出气体,③能发生银镜反应。
请写出两种化合物X的结构简式_____________________、___________________________
(4)下列说法正确的是 ;
a.化合物I遇氯化铁溶液呈紫色
b.化合物II能与NaHCO3溶液反应
c.1mol化合物IV完全燃烧消耗 9.5molO2
d.1mol化合物III最多能与3 molH2 反应
(5)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则 R 在NaOH 醇溶液中反应的化学方程式为 。
正确答案
(1)邻羟基苯甲醛;消去反应(2 分)
(2)
(3 分)
(3)
(每个2分,共4分)
(4)a 、c (4 分)
(5)
(3 分)
或
解析
略
知识点
对于可逆反应H2(g)+I2(g)≒2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是
正确答案
解析
A选项中,速率之比等于计量数之比,应为1:2;B选项出现的净速率在中学没出现过,但根据平均速率的求算,为反应物的净减少量,该项正确;C项明显错误,反应过程中,正反应速率是减小的过程,而逆反应速率是增大的过程;D选项是平衡定义中来,正确。
知识点
往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)
正确答案
解析
略
知识点
扫码查看完整答案与解析





















