- 化学平衡建立的过程
- 共29题
15.一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)
正确答案
解析
从三种情况投料看,Ⅰ和Ⅲ是等效平衡,当平衡时温度高的Ⅲ容器中甲醇的浓度大,说明该反应正向是放热反应,A正确;该反应是气体体积减小的反应,Ⅱ中的量是Ⅰ中的2倍,相当于是将Ⅰ加压,此时平衡向正向移动,Ⅱ中的转化率大,B错误;Ⅱ对Ⅲ相当于的加压,平衡正向移动,因又是相当于降温的反应,平衡同样也向正向移动,故平衡时,容器Ⅱ中c(H2)小于容器Ⅲ中c(H2)的两倍,C错误;投料相同时,容器Ⅲ中的温度高,正反应速率比容器Ⅰ中的大,D正确。
考查方向
解题思路
在相同的条件下,可逆反应无论从正反应开始还是从逆反应开始,还是从既有反应物又有生成物开始,达到的化学平衡状态是相同的,平衡混合物中各组成物质的百分含量保持不变,也就是等效平衡。若Ⅲ的温度也是400K,则建立的平衡与Ⅰ完全等同。Ⅲ的平衡可以看成是Ⅰ达到平衡后升高温度建立的平衡。
易错点
不会利用平衡的转化来思考问题。
知识点
5.一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,
正确答案
解析
A.根据“
B.设容器中总压强为P,由于是恒温恒压下,所以继续加入气体,则压强不变,根据“
C.同理设容器中总压强为P,由于是恒温恒压下,所以继续加入气体,则压强不变,根据“
D.对于一定条件下的同一可逆反应的平衡常数,其数值不同,意义相同,只受到温度的影响,所以D正确。
考查方向
解题思路
A.根据“
B.根据“
C.根据“
D.对于一定条件下的同一可逆反应的平衡常数只与温度有关。
易错点
A.不善于将新信息“用平衡分压代替平衡浓度计算,
B.不能准确应用平衡常数和浓度商的关系进行有关反应方向的判断;
C.不能准确应用平衡常数和浓度商的关系进行有关反应方向的判断;
D.不能正确理解影响化学平衡常数的因素。
知识点
14.常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是
正确答案
解析
A:当水电离出来的H+浓度达到最大值时,首先把H2SO4消耗完之后,再水解才会达到最大值,当氨水的体积为40ml时,氨水的物质的量为0.004mol,但硫酸的浓度不知所以A错
B:NH4+的水解消耗掉部分水电离的OH-,故其浓度差值应该与水解产物的浓度相同,错
C:对水电离促进的反应和抑制的反应作用相互抵消的时候,溶液中存在的NH4+浓度应该刚好和SO42-浓度成2:1,使溶液呈现中性,故C正确
D:NH3·H2O的电离常数中不能确定NH4+浓度,其电离常数无法计算,所以D错
考查方向
解题思路
氨水滴入开始时NH3·H2O+H+=H2O+NH4+,反应b……c点时,NH4++H2O⇌H++NH3·H2O,溶液县酸性,而NH3·H2O⇌NH4++OH-会抑制水的电离,其电离出的OH-与NH4+水解出的H+反应,促进了水的水解,随着氨水的持续加入,抑制NH4+的水解溶液中的NH4+抑制氨水电离,溶液中阳离子有H+、NH4+,阴离子有OH-、SO42-,产生H+的反应有NH4++H2O⇌H++NH3·H2O,消耗H+的反应:NH3·H2O+H+⇌H2O+NH4+,比较以上两个反应式可知,NH4+在其中类似一个过渡参与物,其在溶液中的数量不会变化,当水电离出的H+物质的量浓度为10-7时,NH4+的水解和氨水的电离对水的电离的影响相互抵消,即氨水水解产生的NH4+和水解的NH4+数量达到一致,对水电离的影响抵消,由于题目中没有任何关于体积的信息,故无法判断任何与体积相关的选项,同时由H+的产生和消耗(解除硫酸中H+对水的影响后)反应式知,当氨水与H2SO4完全反应时,水的电解达到最大程度。
易错点
对氨水滴入与酸反应直到氨水过量的过程中与水之间的反应没弄清楚,导致无法判断选项的正确与否
知识点
11.将一定量的SO2(g)和O2(g)分别通入到体积为2 L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+O2(g)
下列说法不正确的是
正确答案
解析
v(SO2)表示的反应速率=
反应起始量相同,达到平衡时氧气物质的量可知,实验2反应进行的程度大,反应是放热反应,温度越高,平衡向吸热反应方向进行,逆向进行,所以温度T1>T2,K2>K1。
x=1.6,y=1.8,所以A项错误。
考查方向
解题思路
实验1从开始到反应达到化学平衡时,
2SO2(g)+O2(g)
起始量(mol) 4 2 0
变化量(mol) 2.4 1.2 2.4
平衡量(mol) x 0.8 2.4
实验2从开始到反应达到化学平衡时,
2SO2(g)+O2(g)
起始量(mol) 4 2 0
变化量(mol) 0.4 0.2 0.4
平衡量(mol) 3.6 y 0.4
易错点
y为氧气的平衡量而不是消耗量
知识点
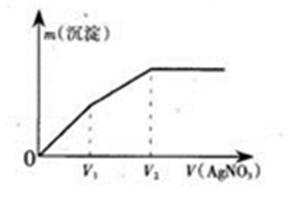
11.往含I一和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示。已知:Ksp(AgCl)=1.8×l0-10, Ksp( AgI) =l.5xl0-16则原溶液中c(I一)/c(Cl-)的比值为
正确答案
解析
因为I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓,可以看出I-、Cl-跟Ag+反应都是1:1的关系,由图中可知:AgI的沉淀量为V1(黄色沉淀是AgI),而AgCl的沉淀量为V2-V1,所以c(I-):c(Cl-)=V1/(V2-V1),故选C。
考查方向
解题思路
分析图像得出AgI的沉淀量和AgCl的沉淀量,而后再进行计算。
易错点
计算错误
知识点
扫码查看完整答案与解析