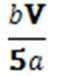- 化学平衡建立的过程
- 共29题
【科目】化学
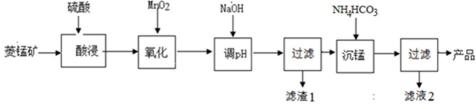
10. 以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。(已知:Ksp(MnCO3) = 2.2×10−11,Ksp[Mn(OH)2] = 1.9×10−13,Ksp[Al(OH)3] = 1.3×10−33)
滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
11.滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
12.取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO4−,反应一段时间后再煮沸5min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L−1 的(NH4)2Fe(SO4)标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
① Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
② “沉锰”前溶液中c(Mn2+) = mol·L−1(列出表达式)。
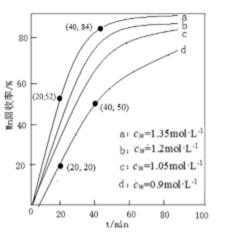
13.其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。
NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
14. 若溶液中c(Mn2+) = 1.0 mol·L−1,加入等体积1.8 mol·L−1 NH4HCO3溶液进行反应,计算20 ~ 40 min内v(Mn2+) = 。
正确答案
(1)Fe(OH)3 Al(OH)3、SiO2
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.滤渣1中,含铁元素的物质主要是Fe(OH)3;加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中SiO2、Al(OH)3溶解;故答案为:Fe(OH)3;SiO2、Al(OH)3;
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.滤渣1中,含铁元素的物质主要是氢氧化铁;加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中氢氧化铝、二氧化硅溶解;
易错点
对公式记忆不清,不能熟练应用
正确答案
Na+、NH4+;
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.滤液2中含有硫酸铵、硫酸钠等,+1价阳离子除了H+外还有:Na+、NH4+,故答案为:Na+、NH4+;
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.
易错点
对公式记忆不清,不能熟练应用
正确答案
① SO42− [或“H2SO4”“Na2SO4”“(NH4)2SO4”] ②
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.①Mn2+被氧化,(NH4)2S2O8中S元素还原为SO42-,故答案为:SO42-;②由Mn元素守恒、电子转移守恒,可得关系式:Mn2+~MnO4-~5Fe2+,则n(Mn2+)=1/5n(Fe2+),所以c(Mn2+)=1/5×V×10−3L×bmol/L/a×10−3L=bV/5amol/L,故答案为:bV/5a
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.由Mn元素守恒、电子转移守恒,可得关系式:Mn2+~MnO4-~5Fe2+,结合关系式计算;
易错点
对公式记忆不清,不能熟练应用
正确答案
① 高 ② 根据Ksp=c(CO32−)·c(Mn2+),c(NH4HCO3)越大,c(CO32-)越大,c(Mn2+)越小,析出的MnCO3越多[或c(NH4HCO3)越大,c(CO32-)越大,使平衡MnCO3(s)
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.①由图可知,NH4HCO3初始浓度越大,锰元素回收率越高;NH4HCO3初始浓度越大,溶液中c(CO32-)度越大,根据溶度积Ksp(MnCO3)=c(Mn2+)×c(CO32-)可知溶液c(Mn2+)越小,析出的MnCO3越多,故答案为:高;NH4HCO3初始浓度越大,溶液中c(CO32-)度越大,根据溶度积Ksp(MnCO3)=c(Mn2+)×c(CO32-)可知溶液c(Mn2+)越小,析出的MnCO3越多;
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.①由图可知,NH4HCO3初始浓度越大,锰元素回收率越高;NH4HCO3初始浓度越大,溶液中碳酸根离子浓度越大,根据溶度积可知溶液c(Mn2+)越小;
易错点
对公式记忆不清,不能熟练应用
正确答案
7.5×10−3 mol·L−1·min−1
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.若溶液中c(Mn2+)=1.0 mol•L-1,加入等体积1.8 mol•L-1NH4HCO3溶液进行反应,混合后NH4HCO3溶液浓度为0.9mol/L,为图象中d曲线,20~40 min内△c(Mn2+)=1mol/L×1/2×(50%-20%)=0.15mol/L,则20~40 min内v(Mn2+)=0.15mol/L/(40−20)min=0.0075mol/(L.min),故答案为:0.0075mol/(L.min).
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.若溶液中c(Mn2+)=1.0 mol•L-1,加入等体积1.8 mol•L-1NH4HCO3溶液进行反应,混合后NH4HCO3溶液浓度为0.9mol/L,为图象中d曲线,根据回收率可以计算△c(Mn2+),进而计算20~40 min内v(Mn2+).
易错点
对公式记忆不清,不能熟练应用
4. 2 5℃时,下列各组离子在指定溶液中一定能大量共存的是( )
正确答案
解析
A.溶液中 的OH- +NH4+ = NH3·H2O, 故不能大量共存;
B.KNO3溶液提供NO3-:NO3- + H++Fe2+→NO↑+Fe3++H2O,故不能大量共存;
C.能使紫色石蕊变红的溶液为酸性溶液,H+与Ca2+、Na+、Cl-、NO3-均不反应,故能大量共存;
D.Cr2O72-不是无色的,是橙色的溶液,故错误。
考查方向
解题思路
依据离子性质及其反应规律筛选。
易错点
易错选B或D。
知识点
6. 利用化石燃料开采、加工过程产生的H2S废气,通过电化学法制取氢气的工艺如图,下列说法不正确的是()
正确答案
解析
C1极生成Fe3+,应发生氧化反应,为阳极,C2极生成氢气,为阴极,发生还原反应,故A正确;
电解池中生成的FeCl3可作为反应池的反应物,则FeCl3溶液可循环利用,故B正确;
由装置可知反应池中的反应物为H2S和FeCl3,生成物S和Fe2+,则反应的化学方程式为H2S+2FeCl3=2FeCl2+S↓+2HCl,离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,故C错误;
反应池中发生氧化还原反应为H2S+2FeCl3=2FeCl2+S↓+2HCl,电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为Fe+2HCl═FeCl2+H2↑,故D正确。
考查方向
解题思路
A:C1极生成Fe3+,应发生氧化反应,为阳极,C2极生成氢气,为阴极,发生还原反应;
B:电解池中生成的FeCl3可作为反应池的反应物,则FeCl3溶液可循环利用;
C:由装置可知反应池中的反应物为H2S和FeCl3,生成物S和Fe2+,则反应的化学方程式H2S+2FeCl3=2FeCl2+S↓+2HCl,离子方程式为2Fe3++H2S=2Fe2++S↓+2H+;
D:反应池中发生氧化还原反应为H2S+2FeCl3=2FeCl2+S↓+2HCl,电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为Fe+2HCl═FeCl2+H2↑
易错点
对正负极,阴阳极判断不正确
知识点
6.下列说法正确的是()
正确答案
解析
A.△H=逆反应的活化能-正反应的活化能=(Ea-Eb)kJ•mol-1,故A错误。
B.饱和溶液的溶质质量分数=
C.将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度增大,Ka(HF)保持不变,氟离子浓度和氢离子浓度比值基本不变,故C错误。
D.0.2mol•L-1的CH3COOH溶液与0.1molL的NaOH溶液等体积混合后,得到的是等浓度的醋酸和醋酸钠的混合物,电荷守恒:c(Na+)+c(H+)═c(CH3COO-)+c(OH-),物料守恒:2c(Na+)═c(CH3COO-)+c(CH3COOH),由此得到:2c(H+)-2c(OH-)═c(CH3COO-)-c(CH3COOH),故D正确。
考查方向
解题思路
A.反应A(g)⇌2B(g),若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,反应的焓变等于正逆反应活化能之差。
B.某温度下,100g水中溶解氯化钠的最大质量即是其溶解度。
C.弱酸加水稀释,其电离度增大,电离平衡常数不变,氟离子和氢离子物质的量同等程度的增大.
D.0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合后,溶质为等浓度的醋酸和醋酸钠,结合物料守恒和电荷守恒分析;
易错点
弱电解质的水解的电荷和物料守恒。
知识点
5.常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是( )
正确答案
解析
A.将pH=2的HA稀释100倍后,溶液的pH变化小于2,说明HA为强电解质,溶液中存在电离平衡,HA的电离方程式为:HA=H++A-,故A错误;B.根据图象可知,pH2的HA稀释100倍后,溶液的pH变化为2,则HA为强电解质,溶液中完全电离,则pH=2的HA溶液的浓度为0.01mol/L,而HB为弱酸,则稀释前HB的浓度大于0.01mol/L,即:稀释前,c(HB)>c(HA)=0.01mol•L-1,故B正确;C.0.1mol/L NaB溶液中,根据质子守恒可得c(OH-)= c(H+)+C(HB),故C错误;D.当NaA、NaB的浓度相等时,根据物料守恒可得:2c(Na+)=c(A-)+c(B-)+c(HB),由于不知NaA、NaB的浓度大小,无法得出2c(Na+)=c(A-)+c(B-)+c(HB),故D错误;
本题正确答案是B
考查方向
解题思路
A.根据图象曲线变化可知,将pH=2的HA稀释100倍后,溶液的pH=4,所以HA为弱酸,溶液中完全电离;B.溶液稀释100倍,HA溶液的pH变化为2,则HA为强酸,而HB为弱酸,据此判断稀释前浓度大小;C.0.1mol/L NaB溶液中,根据质子守恒可得c(OH-)= c(H+)+C(HB)D.没有告诉NaA、NaB的浓度是否相等,无法根据物料守恒得出2c(Na+)=c(A-)+c(B-)+c(HB).
易错点
PH与溶液酸碱性的关系、离子浓度大小及电荷守恒、物料守恒、质子守恒的应用。
知识点
扫码查看完整答案与解析