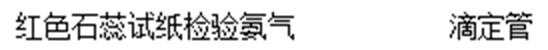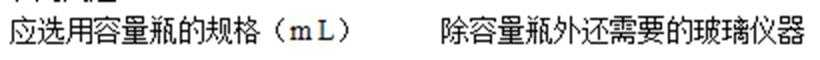- 溶液的配制
- 共10题
his
正确答案
下列有关实验原理或实验操作正确的是
正确答案
解析
本题属于基础实验与基本实验操作的考查范畴。
A.pH试纸用水湿润将冲稀待测溶液。
B.0.5000 mol·L-1 H2SO4溶液与水混合,混合溶液的体积不是两者的简单之和。
C.收集试管带塞子将无法收集到氨气。
D.根据溶解平衡原理,Cl2在饱和食盐水溶解度很小,而HCl极易溶解。
本题以pH试纸试用、常见气体制取、溶液配制、除杂中的实验操作为素材,考查学生对实验操作的熟悉程度和实验原理的应用能力,试图引导中学化学教学关注化学实验操作的真实性。
知识点
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
正确答案
解析
略
知识点
下列实验操作或装置(略去部分加持仪器)正确的是
正确答案
解析
略
知识点
下列叙述正确的是( )
正确答案
解析
略
知识点
31.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是( ) 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的( )。
a.烧杯
b.容量瓶
c.玻璃棒
d.滴定管
(2)
加入NH3·H2O调节pH=8可除去( )(填离子符号),滤渣Ⅱ中含( )(填化学式)。加入H2C2O4时应避免过量,原因是( )。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4↓
步骤Ⅰ 移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的( )(填“上方”或“下方”)。BaCl2溶液的浓度为( )mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
正确答案
(1)增大接触面积从而使反应速率加快;ac
(2)Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少。
(3)上方;(V0b—V1b)/y;偏小。
解析:(1)充分研磨可以增大反应物的接触面积,增大反应速率;因为配制的盐酸溶液浓度为质量分数,可以计算出浓盐酸的体积和水的体积,所以使用烧杯作为容器稀释,玻璃杯搅拌。
(2)根据流程图和表中数据,加入NH3•H2O调pH为8,只有Fe3+完全沉淀,故可除去Fe3+;加入NaOH调pH=12.5,Mg2+也完全沉淀,Ca2+部分沉淀,所以滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;根据Ksp(BaC2O4)=1.6×10-7,H2C2O4过量时Ba2+转化为BaC2O4沉淀,BaCl2·2H2O产品的产量减少。
(3)“0”刻度位于滴定管的上方;与Ba2+反应的CrO42‾的物质的量为(V0b—V1b)/1000mol,则Ba2+浓度为(V0b—V1b)/y;根据计算式,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大。
解析
解析已在路上飞奔,马上就到!
知识点
29.(1)指出在使用下列仪器(已净)或用品的第一步操作:
(2)下面是中学化学实验常见的几种仪器:
(3)现有50mL的容量瓶装水至刻度线,50mL的量筒装水至50mL刻度线,都正确读数,则两
容器中所装水的体积前者_______后者(填“=”“>”“<”)
(4)某实验需用到物质的量浓度为0.2mol/LNaOH溶液480mL,现用氢氧化钠固体进行配制。
填空并请回答下列问题:
①下列操作对配制的NaOH溶液浓度有偏高影响的是( ) 。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的NaOH固体露置在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶进行定容
②用所配的NaOH溶液滴定锥形瓶内未知浓度的盐酸,酚酞作指示剂,当锥形瓶内现象为
__________________________________________________________,即到了滴定终点。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.某化学小组为测定加碘盐中KIO3的质量分数并制备少量KIO3 ,进行了如下实验。I.测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:KIO3+3H2SO4+5KI=3I2+3K2CO3+3H2O ; I2+2Na2S2O3=2NaI+ Na2S4O6
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol·L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据;重复滴定2次,平均消耗Na2S2O3溶液12.00 mL。
(1)步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有( )。
(2)步骤三中到达滴定终点时的现为( )。
(3)实验测得此加碘盐中KIO3的质量分数= ( )。
Ⅱ.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到。
该化学小组通过以下装置制备KIO3。
(4)装置A中反应的离子方程为( )。
(5)装置B中的试剂为( )。
(6)写出装置C中生成KIO3的离子方式 ( )。
(7)上述实验装置存在一处明显缺陷,请出 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.(14分)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式:( ) 。
(2)操作⑤中加酸酸化后

(3)步骤③中测定pH值的操作为:_________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
(5)称取重铬酸钾(其式量为294)试样2.5000 g配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol/LH2SO4和足量碘化钾(铬的还原产物为Cr 3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/LNa2S2O3标准溶液滴定(
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需( )和 ( )。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)( ) 。(保留2位小数)
27.重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是:
6FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式: 。
(2)操作⑤中加酸酸化后CrO

(3)步骤③中测定pH值的操作为:_________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
(5)称取重铬酸钾(其式量为294)试样2.5000 g配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr 3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2 + 2S2O


①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需 和 。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应) 。(保留2位小数)
正确答案
29.(1)指出在使用下列仪器(已净)或用品的第一步操作:
(2)下面是中学化学实验常见的几种仪器:
(3)现有50mL的容量瓶装水至刻度线,50mL的量筒装水至50mL刻度线,都正确读数,则两
容器中所装水的体积前者_______后者(填“=”“>”“<”)
(4)某实验需用到物质的量浓度为0.2mol/LNaOH溶液480mL,现用氢氧化钠固体进行配制。
填空并请回答下列问题:
①下列操作对配制的NaOH溶液浓度有偏高影响的是 ( )。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的NaOH固体露置在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶进行定容
②用所配的NaOH溶液滴定锥形瓶内未知浓度的盐酸,酚酞作指示剂,当锥形瓶内现象为
__________________________________________________________,即到了滴定终点。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析