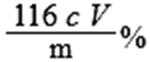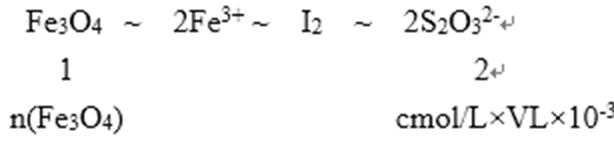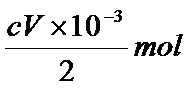- 淀粉的性质和用途
- 共12题
[化学—有机化学基础]
化合物F、I是制备香料的重要物质。
合成F路线:
合成I路线:
已知:
①核磁共振氢谱显示,A中只有一种氢,芳香族化合物G中有四种氢且个数比为
1︰2︰2︰3。
②R—CH=CH2
③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
20.A 的名称是________________,D所含的官能团是______________。
21.C的结构简式为_____________。
22.A→B的反应类型为_____________,G→H的反应类型为_____________。
23.分子式为C8H10O且与G互为同系物的同分异构体有_____________种,写出其中一种的结构简式_____________。
24.写出由H→I的第一步反应的化学方程式__________________________。
25.设计一个以甲苯为原料制备苯甲酸的合成路线_____________。
正确答案
2-氯-2-甲基丙烷 羟基(或-OH)
解析
核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



A为(CH3)3CCl,A 的名称是 2-氯-2-甲基丙烷,D为(CH3)2CHCH2OH,D所含的官能团是羟基(或-OH),故答案为:2-氯-2-甲基丙烷;羟基(或-OH);
考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
解析
根据上面的分析可知,C为

考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
消去反应 取代反应
解析
根据上面的分析可知,A→B的反应类型为 消去反应,G→H的反应类型为 取代反应,
故答案为:消去反应;取代反应;
考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
9
解析
G为


考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
解析
由H→I的第一步反应的化学方程式为



考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
正确答案
解析
以甲苯为原料制备苯甲酸,可以用甲苯与氯气发生取代生成二氯甲苯,再碱性水解可得苯甲醛,苯甲醛氧化可得苯甲酸,合成路线为
,故答案为:
考查方向
解题思路
根据题意其核磁共振氢谱显示,A中只有一种氢,根据A的分子式可知A为(CH3)3CCl,A在氢氧化钠的醇溶液中发生消去反应生成B为(CH3)2C=CH2,B发生加聚反应生成C为



易错点
有机化合物结构的确定和官能团的性质、合成路线的设计。
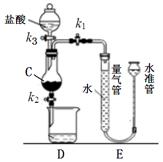
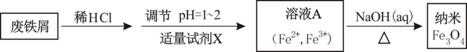
利用废铁屑(含少量铁锈——Fe2O3)制
用如右图装置制备溶液A,其实验步骤为:
Ⅰ.打开k1,关闭k2,并打开k3,缓慢滴加盐酸;
Ⅱ.当……时,关闭k3,对装置E进行读数操作;
Ⅲ.关闭k1,打开k2、k3,使C容器中的溶液完全进入烧杯;
Ⅳ.往烧杯中加入适量试剂X,得到溶液A。
请回答:
31.盛放盐酸的仪器名称为_________________。
32.要粗略测定废铁屑中铁的质量分数,可通过装置E测出C容器中生成气体的体积。
①下列相关叙述正确的是_________________(填选项字母)
a.用CCl4代替E中的水,测得气体的体积更准确
b.量气管压入水准管的水过多而溢出,会导致测定失败
c.必须待装置恢复到室温且量气管与水准管两端液面相平才可进行读数
②操作Ⅱ中“……”的内容是_________________。
33.制备溶液A,试剂X可以选择_________________(填选项字母)。
34.写出由溶液A制备纳米Fe3O4的离子方程式________,制备过程中须持续通入N2,原因是_________。
35.Fe3O4的纯度通常可用碘量法测定:称取m g Fe3O4样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是_________________。
②样品中Fe3O4的质量分数_________________。
正确答案
分液漏斗
解析
根据实验装置可知盛放盐酸的仪器名称为分液漏斗,故答案为分液漏斗
考查方向
解题思路
根据实验装置可知盛放盐酸的仪器名称为分液漏斗
易错点
离子反应方程式的书写、氧化还原反应滴定的原理
正确答案
①c②容器C中固体完全消失或容器C中不产生气泡
解析
要粗略测定废铁屑中铁的质量分数,可通过装置E测出C容器中生成气体的体积,对量气管的操作和要求有量气管内液体不能溶于产生的气体或与气体反应;反应前后都要使量气管和水准管液面持平,已保证读数的准确性。
①a、氢气为非极性分子,CCl4为非极性分子,根据相似相溶原理,部分氢气溶在CCl4中,造成测量误差,b、装置中的水有两个作用,封闭量气管内的气体不与大气相通,指示量气管内、漏斗内液面位置,所以溢出对测定无影响,c、必须待装置恢复到室温且量气管与水准管两端液面相平才可进行读数,保证压强与大气压相同,正确,故答案为c
②当Fe3O4与HCl反应结束后,所以现象为固体完全溶解或无气体产生故答案为容器C中固体完全消失或容器C中不产生气泡。
考查方向
解题思路
要粗略测定废铁屑中铁的质量分数,可通过装置E测出C容器中生成气体的体积,对量气管的操作和要求有量气管内液体不能溶于产生的气体或与气体反应;反应前后都要使量气管和水准管液面持平,且量气管内溶液不能减少,已保证读书准确性。理解这些可答此题
易错点
离子反应方程式的书写、氧化还原反应滴定的原理
正确答案
解析
废铁屑(含少量铁锈——Fe2O3)与盐酸反应可得到含Fe2+ 溶液,要制备溶液A(Fe2+、Fe3+ 溶液)加入氧化剂即可,常见氧化剂如H2O2、Cl2 、HNO3 故答案为a.b.d
考查方向
解题思路
废铁屑(含少量铁锈——Fe2O3)与盐酸反应可得到含Fe2+ 溶液,要制备溶液A(Fe2+、Fe3+ 溶液)加入氧化剂即可,常见氧化剂如H2O2、Cl2 、HNO3
易错点
离子反应方程式的书写、氧化还原反应滴定的原理
正确答案
【答案】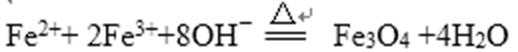
解析
根据题意,由溶液A加入NaOH溶液制备纳米Fe3O4 离子反应为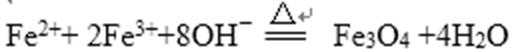
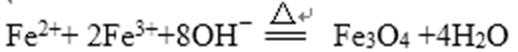
考查方向
解题思路
根据题意,由溶液A加入NaOH溶液制备纳米Fe3O4 离子反应为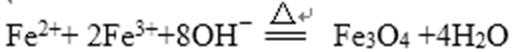
易错点
离子反应方程式的书写、氧化还原反应滴定的原理
正确答案
①溶液由蓝色变无色,且半分钟不变色②
解析
Fe3O4样品,溶于稀盐酸,Fe3O4 + 8H+ == Fe2+ +2 Fe3+ +4H2O 溶液中含有Fe3+离子,具有氧化性,过量的KI则 2 Fe3+ +2 I‾ == 2Fe2+ + I2 ,反应后滴入几滴淀粉溶液,溶液呈蓝色。后用 Na2S2O3溶液滴定,其原理为已知:I2+2S2O32-═2I-+S4O62-,故滴定的终点即I2消耗完,其变化为溶液由蓝色变无色,且半分钟不变色,
利用关系式法
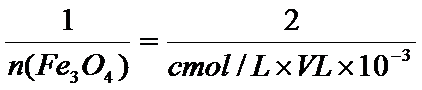
Fe3O4样品,溶于稀盐酸,配制成100mL溶液;取出10.00ml可得m g Fe3O4 样品中Fe3O4物质的量为:5cV×10-3 mol
其质量分数为:W(Fe3O4)=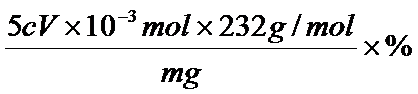
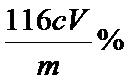
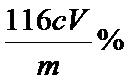
考查方向
解题思路
Fe3O4样品,溶于稀盐酸,Fe3O4 + 8H+ == Fe2+ +2 Fe3+ +4H2O 溶液中含有Fe3+离子,具有氧化性,过量的KI则 2 Fe3+ +2 I‾ == 2Fe2+ + I2 ,反应后滴入几滴淀粉溶液,溶液呈蓝色。后用 Na2S2O3溶液滴定,其原理为已知:I2+2S2O32-═2I-+S4O62- ,滴定的终点即I2消耗完,其变化为溶液由蓝色变无色,且半分钟不变色,利用关系式法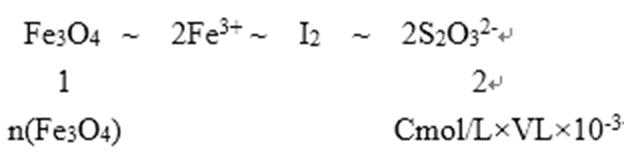
易错点
离子反应方程式的书写、氧化还原反应滴定的原理
扫码查看完整答案与解析