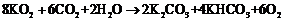- 物质的量浓度的计算
- 共63题
29.CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O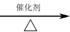
已知:CO+2H2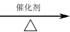
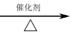
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
正确答案
(1)89.6 (2)2.4 mol/L≥c≥1.2 mol/L(3)
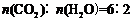
设CO2转化率为α,CO转化率为β300β+100α=350 600β+300α=900-120 α=80%或设CO2转化率为α 900−350×2−100α=120 α=80/100=80%
知识点
6.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
正确答案
解析
A、已知酸性:CH3COOH>H2CO3>Al(OH)3,所以水解程度:偏铝酸钠>碳酸氢钠>醋酸钠,当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是①>②>③,故A不选;
B、结合物料守恒分析可知,溶液中钠离子和碳原子的物质的量之比为(0.5×2+a):(0.5+a),c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3),故B不正确;
C、10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,发生反应,生成0.001mol醋酸钠、剩余0.001mol氢氧化钠,醋酸钠和氢氧化钠的物质的量相同,
物料守恒得:c(Na+)= 2[c(CH3COO-)+c(CH3COOH)] ,
电荷守恒得:c(Na+)+c(H+)= c(CH3COO-) +c(OH-) , 二式联立,化简得:
c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)D、25℃某浓度的NaCN溶液的pH=d,该溶液中c(OH-)=10d-14mol/L,即水电离出的c(OH-)=10d-14mol/L,故D不正确;
考查方向
本题主要考查溶液中三大守恒关系:物料守恒、电荷守恒、质子守恒,溶液中离子浓度大小的比较。
解题思路
A项:酸性:CH3COOH>H2CO3>Al(OH)3,根据越弱越水解,水解度:NaAlO2>NaHCO3 >CH3COONa, c(Na+):①>②>③;B项根据物料守恒分析;C项正确;D项NaCN溶液的OH-全部来自于水的电离。
易错点
弱酸、弱碱的电离以及盐类的水解都是很弱的。越弱越水解是盐类的水解的重要规律之一。
知识点
22.将5.6gFe投入浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到20gFe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红棕色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为
正确答案
解析
因最后气体为NO,设其物质的量为x,
铁与浓硝酸反应时,铁失去电子,氮元素得到电子,且A为二氧化氮,
在Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,是亚铁失去电子,氮元素得电子,且B为氧气,
A、B气体混合通入足量水生成硝酸和NO,
根据守恒思想,计算时抓住反应的始终态即可,反应物可看作Fe、HNO3和水,最终生成物是Fe2O3和剩余气体,A和B混合气体通入水中,剩余气体是NO或O2,根据电子得失守恒可定性判断出剩余气体不可能是O2,则剩余气体只能是NO,设其物质的量为x,则整个过程中由得失电子守恒可知,

考查方向
解题思路
明确发生的化学反应,注意元素化合价的变化,明确最后的物质,利用电子守恒来快速计算是解答的关键,从而可避免中间过程的繁杂计算.
易错点
利用电子守恒计算
知识点
7.下列实验能达到预期目的是( )
正确答案
解析
A.NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比较HClO和CH3COOH的酸性强弱。错误。B. Na2CO3是强碱弱酸盐,水解消耗水电离产生的H+而使溶液显碱性,因此向该盐的水溶液中滴加酚酞变为红色。若向含有酚酞的Na2CO3溶液中加入少量BaC12固体,会发生反应:CO32-+Ba2+=BaCO3↓,使CO32-的水解平衡逆向移动。水解程度减小,所以溶液的减小减弱,溶液红色变浅。正确。C. 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀。但是该沉淀存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),当再滴加2滴0.1 mol/LFeCl3溶液时由于,c(Fe3+)·c(OH-)≥Ksp [Fe(OH)3],所以又生成红褐色沉淀。由于Mg(OH)2 和Fe(OH)3的构型不同,因此这只能证明沉淀在溶液中存在沉淀溶解平衡,而不能证明其Ksp的大小。错误。D.证明元素的非金属性的强弱,要看其最高价氧化物对应的水化物的酸性强弱。Na2SO3不是S的最高价含氧酸的钠盐。错误。
考查方向
本题考查元实验设计,考查学生解决问题的能力
解题思路
对与电解质在溶液中需要考虑是否溶解,溶解是否电离,是否再次电离,电离是否完全,电离出了阴阳离子是否水解,水解是否分步,溶液中存在的阴阳离子是否符合离子反应条件。这是解决此类问题的一般思路。
易错点
实验设计的科学性、合理性、严谨性容易导致学生判断
知识点
4. 下列溶液中微粒浓度关系一定正确的是 ( )
正确答案
解析
A.酸碱的强弱未知,反应后不一定呈中性,如为强酸强碱,则c(OH-)=c(H+),如为弱酸强碱,则c(OH-)<c(H+),如为强酸弱碱,则c(OH-)>c(H+),A错误;
B.NH4+水解,且水解程度较小,溶液呈酸性,则存在c(NH4+)>c(SO42-)>c(H+)>c(OH-),B错误;
C.根据质子守恒可知,溶液中应存在c(OH-)=c(H+)+c(HS-)+2c(H2S),C错误;
D.氢氧化钠与氯化铵的pH=7的混合溶液中存在c(Cl-)+c(OH-)=c(NH4+)+c(H+)+c(Na+),因c(OH-)=c(H+),则c(Cl-)=c(NH4+)+c(Na+),D正确。
故选D。
考查方向
解题思路
A.酸碱的强弱未知,反应后不一定呈中性,如为强酸强碱,则c(OH-)=c(H+),如为弱酸强碱,则c(OH-)<c(H+),如为强酸弱碱,则c(OH-)>c(H+);
B.NH4+水解,且水解程度较小,溶液呈酸性,则存在c(NH4+)>c(SO42-)>c(H+)>c(OH-);
C.根据质子守恒可知,溶液中应存在c(OH-)=c(H+)+c(HS-)+2c(H2S);
D.氢氧化钠与氯化铵的pH=7的混合溶液中存在c(Cl-)+c(OH-)=c(NH4+)+c(H+)+c(Na+),因c(OH-)=c(H+),则c(Cl-)=c(NH4+)+c(Na+)。
易错点
本题考查离子浓度大小比较,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握盐类水解的特点,结合电荷守恒、物料守恒解答该题,难度中等。
知识点
扫码查看完整答案与解析