- 化学平衡的影响因素
- 共48题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有 和 以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: 。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,
① ②
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
已知298K时, Ksp(CaCO3)=2.80×10-9, Ksp(CaSO4)=4.90×10-5 ,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
正确答案
见解析。
解析
(1) Ca(OH)2 Mg(OH)2
(2) 氢氧根与镁离子结合,使平衡向右移动,K+变多
(3) K2CO3 H2SO4
(4) ①在同一时间K+的浸出浓度大。②反应的速率加快,平衡时溶浸时间短。
(5)K=1.75×104
知识点
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为__________;
(2)估算该反应的平衡常数__________(列式计算)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向__________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将__________(填“增大”、“减小”或“不变”),平衡将向__________移动。
正确答案
(1)
(2)
C起 0.09 0 0 0
C变 0.09×
C平 0.06 0.03 0.03 0.03

(3)正反应方向;
(4)增大,正反应方向
解析
略。
知识点
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)
下列说法正确的是
正确答案
解析
本题素材似乎来源于《选修四》课本第32页习题的第8题,属于基本理论中化学平衡问题,主要考查学生对速率概念理解与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。高三复习要让学生深刻理解一些基本概念的内涵和外延。A反应在前50 s内的平均速率应该是前50 s内PCl3浓度变化与时间的比值,而不是PCl3物质的量的变化与时间的比值。B相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2应先求平衡常数K为0.025,再求浓度商(Qc)为0.02,K>Qc,说明平衡向正反应方向移动。C保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大。D从等效平衡的角度,先建立原容器两倍关系的模型,即与原平衡完全等效,再把容器两倍关系压缩成原容器,则平衡向逆反应方向移动,PCl3的转化率应大于80%
知识点
高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
a.减少Fe的量
b.增加Fe203的量
c.移出部分C02
d.提高反应温度
e.减小容器的容积
f.加入合适的催化剂
正确答案
(1)K=
(2)0.006 mol·L-1·min-1;60%
(3)c
解析
本题主要考察化学反应速率的概念及计算、外界条件对化学平衡的影响、化学平衡常数的概念及计算以及反应热的有关判断。(1)平衡常数是指在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积当比值,但需要注意但是固体和纯液体的浓度视为常数,不能出现在表达式中;从表中数据可知随着温度的升高平衡常数逐渐减小,这说明温度升高平衡向逆反应方向移动,所以正反应是放热反应,即△H<0。(2)
在1000℃时K=4.0,所以有
因此C02的浓度变化量为:c(C02)=




CO的转化率为
(3)因为该反应是一个放热且体积不变的可逆反应,所以要提高CO的平衡转化率,可以采取降低温度或降低生成物浓度来实现,而固体和催化剂不能改变平衡状态,所以选项c正确。
知识点
硫—碘循环分解水制氢主要涉及下列反应:
SO2+2H2O+I2==H2SO4+2HI
2HI
2H2SO4== 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是______。
a.反应III易在常温下进行 b.反应I中的SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应II,H2物质的量随时间的变化如图所示。
0-2min内的平均反应速率v(HI)=______.
该温度下,H2(g)+ I2(g)
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_____是原来的2倍。
a.平衡常数 b. HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡_____移动(填“向左”“向右”或“不”);若加入少量下列试剂中的_____。产生H2的速率将增大。
a. NaNO3 b. CuSO4 c. Na2SO4 d. NaHSO4
(4)以H2 为燃料可制作氢氧燃料电池。
已知2 H2(g)+ O2(g)= 2 H2O (1) ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol 液态水,该电池的能量转化率为_______。
正确答案
(1)c;
(2)0.1mol·L-1·min-1;64mol/L;b。
(3)向右;b。
(4)80%。
解析
(1)H2SO4在常温下,很稳定不易分解,这是常识,故a错;反应Ⅰ中SO2是还原剂,HI是还原产物,故还原性SO2>HI,则b错;将Ⅰ和Ⅱ分别乘以2和Ⅲ相加得:2H2O==2H2+O2,故c正确d错误。
(2)υ (H2)=0.
2HI(g)==H2(g)+I2(g)
2 1 1
起始浓度/mol·L-1 1 0 0
变化浓度/mol·L-1: 0.2 0.1 0.1
平衡浓度/mol·L-1: 0.8 0.1 0.1
则H2(g)+I2(g) 

若开始时加入HI的量是原来的2倍,则建立的平衡状态和原平衡等比平衡,HI、H2、I2的物质的量、平衡浓度都是原来的两倍;各组分的百分含量、体积分数相等,平衡常数相等(因温度不变);因开始时的浓度增大了,反应速率加快,达平衡时间不可能是原来的两倍,故选b。
(3)水的电离平衡为H2O 
(4)根据反应方程式,生成1mol的水放出的热量为:572kJ×1/2=286kJ,故该电池的能量转化率为(228.8 kJ /286 kJ ) ×100%=80%。
知识点
在温度、容积相同的3个密闭容器中,按不同方式

下列说法正确的是
正确答案
解析
略
知识点
某恒温密闭容器中,可逆反应A(s)
正确答案
解析
略
知识点
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)
正确答案
解析
略
知识点
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应;
xA(g)+yB(g) 
已知:平均反应速率VC=VA/2;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。
回答下列问题:
(1)反应2min内,VA = ,VB ;
(2)化学方程式中,x= 、y= 、p= 、q= ;
(3)反应平衡时,D为 2amol,则B的转化率为 ;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的ΔH 0;(填“>”、“<”或“=”)
(5)如果其他条件不变,将容器的容积变为 1L,进行同样的实验,则与上述反应比较:
①反应速率 (填“增大”、“减小”或“不变”),理由是 ;
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由是 ;
正确答案
(1)a/12 mol·L-1·min-1 a/8 mol ·L-1·min-1
(2)2 3 1 6
(3)
(4)<
(5)①增大 体积减小,反应物的浓度增大,因而使反应速率增大
②减小 体积减小,气体的压强增大,平衡向气体分子数少的方向(即逆反应方向)移动,因而使反应物转化率减小
解析
略
知识点
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
正确答案
(1)① 大于 ② 0.0010 ③0.36mol·L-1
(2)a:④大于
⑤ 反应正方向吸热,反应向吸热方向进行,故温度升高
b:⑥平衡时,c(NO2)= 0.120mol·L-1 +0.0020mol·L-1·S-2×10s×2=0.16mol·L-1
c(N2O4)=0.040 mol·L-1-0.0020 mol·L-4×10s=0.020 mol·L-1
K2= 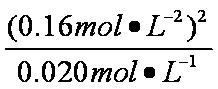
(3)逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
解析
略
知识点
扫码查看完整答案与解析