- 化学平衡的影响因素
- 共48题
26.某校化学小组学生利用下图装置进行“氨的催化氧化及其产物验证”实验。(图中夹持装置已略去)
(1)装置B中盛放的试剂( )(填名称),作用是( )。
(2)反应开始时,将装置C中铂丝加热到红热,撤去酒精灯,铂丝变暗。此时鼓入空气,铂丝又变红热。这是因为氨的催化氧化是( ) 反应。该反应的化学方程式为( )。
(3)实验过程中,装置D中的导管容易生成无色晶体而堵塞。为了解决该问题,可以在活塞a后增加 ( )(选填序号)。
①盛有蒸馏水的洗气瓶 ②盛有浓盐酸的洗气瓶 ③盛有碱石灰的U形管
(4)反应一段时间后,装置E中的气体颜色应为( )色。此时,装置E中的含氮化合物有NO、NO2、( )(填化学式)。
(5)反应一段时间后,装置F中的紫色石蕊试液变红,其原因是(写出化学方程式)( )。
(6)实验结束时,应先停止加热,并继续( ) 直至C中玻璃管冷却。
(7)工业上合成氨的反应是:N2(g) + 3H2(g)
①下列做法能够提高工业合成氨转化率的是( )(选填字母)
a.增大压强 b.升高温度
c.使用铁触媒 d.将生成的NH3及时从混合气体中分离出去
②工业合成氨时采用500℃左右的温度,主要是因为( )。
正确答案
(1)碱石灰; 除去氨气中的水蒸汽
(2)放热;
(3)①
(4)红棕色; N2O4
(5)3NO2 + H2O=2HNO3 + NO,HNO3=H++NO3-,H+使紫色石蕊试液变红
(6)通入空气
(7)①ad ②该温度时催化剂的活性最大,化学反应速率较快
解析
解析已在路上飞奔,马上就到!
知识点
27.在容积为2L,且体积保持不变的密闭容器内加入0.4molN2和1.2molH2,在一定条件下发生如下反应:N2(g)+3H2(g)
(1)从反应开始到平衡时,平均反应速率v(NH
(2)若改变某一条件使平衡向正反应方向移动,则v(正)( )。
a.不变 b.减小
c.增大 d.均有可能



(4)能说明反应达到平衡的是( )。
a.n(N2)和n(H2)之比保持不变 b.一个N
c.体系中气体密度保持不变 d.H2的减少速率,等于NH3的生成速率
e.体系中平均分子量保持不变 f.N2、H2、NH3的物质的量浓度相等
(5)第5min,若改变反应温度,则NH3的浓度不可能为 ( ) mol·L-1。
a.0.40 b.0.12 c.0.10 d.0.08
(6)在第5min将容器压缩一半体积,若在第8min达到新的平衡(NH3的浓度约为0.25 mol·L-1),请在上图中画出第5~9分钟内NH3浓度的近似变化曲线。
正确答案
(1)0.025mol/(L.min)
(2)d
(3)cd
(4)be
(5)ac(
(6)图见下
解析
解析已在路上飞奔,马上就到!
知识点
7. 25℃时,水的电离达到平衡

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.某温度下,反应
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.(15分)氮的固定是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)
目前工业合成氨的原理是:N2(g)+3H2(g)
(1)写出氢气燃烧热的热化学方程式 ( ) 。
(2)在恒温恒容密闭容器中进行的工业合成氨反应,下列能表示达到平衡状态的是
(填序号)。
A.混合气体的压强不再发生变化
B.混合气体的平均相对分子质量不再发生变化
C.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
D.单位时间内断开3a个H-H键的同时形成6a个N-H键
E.反应容器中N2、NH3的物质的量的比值不再发生变化
(3)在恒温恒容的密闭容器中,工业合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
①前25min 内,用N2的浓度变化表示的化学反应平均速率是 ( ) 。
②在25min 末反应刚好达到平衡,则该温度下反应的平衡常数K=( ) (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(4)如果向0.014mol/L的MgCl2溶液中通入一定量的氨气(溶液体积变化忽略不计),
请计算溶液中OH—的浓度大于 ( ) mol/L时,溶液中开始出现白色沉淀。(Ksp[Mg(OH)2]=5.6×10-12)
(5)常温下PH=11的氨水和PH=3的盐酸两溶液等体积混合,所得溶液中离子浓度关系为:
( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.X为某金属矿的主要成份,X具有下列转化关系(部分反应物、生成物没有列出)
已知:1moL X经一系列变化只生成A、B、C,且物质的量之比为1:2:1,X不含氧元素。请回答:
(1)(2分)X的化学式为 ( ) ;
(2)(2分)写出物质A名称 ( ) ;物质G名称: ( ) ;
(3)(4分)写出下列反应方程式:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.已知反应

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.在一体积不变的密闭容器中发生化学反应:2A(g)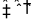

下列有关说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.对达到平衡状态的可逆反应X+Y
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述中正确的是 ( )
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析