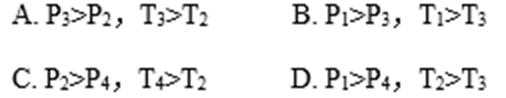- 用盖斯定律进行有关反应热的计算
- 共44题
某废水中含有的NH
① NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH = -273kL/mol
② NO2-(aq)+1/2O2(g)=NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
正确答案
解析
略
知识点
近两年我国大多城市都受到雾霾天气的影响,雾霾的形成与氮的氧化物和硫的 氧化物有关:
已知:2SO2(g)+O2(g)
2NO(g)+O2(g)
(1)则反应NO2(g)+SO2(g)
(2)某温度时,在一个容积为10L的密闭容器中进行反应①。开始充入4。0 mol SO2和2。0 molO2,半分钟后达到平衡,并放出352。8 kJ的热量。此时SO2的转化率是 ___________,该温度下的平衡常数K=____________。
(3)利用钠碱循环法可脱除工业废气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___________________。
②吸收液吸收SO2的过程中,pH随n(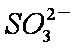
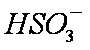
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母)_____________。
a。c(Na+)=2c(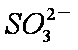
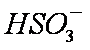
b。c(Na+)>c(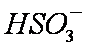
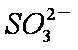
c。c(Na+)+c(H+)=c(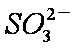
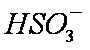
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性, 原因是__________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,所滴加氨水的浓度为_________mol·L-1(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)。
正确答案
(1) —41.8
(2)90% 4050
(3)①2OH-+SO2===H2O+SO ②ab
(4)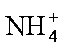

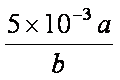
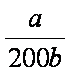
解析
略
知识点
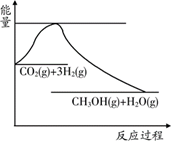
为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g) + 3H2(g)
(1)上图表示该反应过程中能量变化,则该反应为 反应(填“吸热”或“放热”),判断依据是 ;
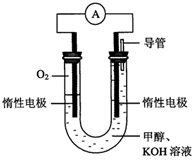
(2)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池正极的电极反应式为: ;
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为: ;
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)为了消除污染,在一定条件下,向含有甲醇的废水中加入一定量的稀硝酸,会有N2等物质生成。若参加反应的氧化剂和还原剂的物质的量之比为6∶5,写出该反应的化学方程式 ;在此反应过程中若消耗32 g 甲醇,将转移
mol 电子。
正确答案
见解析。
解析
(1)放热; 生成物总能量低于反应物总能量 ;
(2) ① O2 + 2H2O + 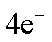
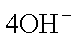
② 2CH3OH + 3O2 + 4KOH = 2K2CO3 + 6H2O ;
(3)CH3OH(l) + O2(g) = CO(g) + 2H2O(l) ΔH =﹣442.8 kJ∕mol ;
(4)5CH3OH + 6HNO3 = 3N2 ↑ + 5CO2 ↑ + 13H2O ; 6 。
知识点
大气中的部分碘源于O3对海水中Ⅰ-的氧化。将O3持续通入NaⅠ溶液中进行模拟研究。
(1)O3将Ⅰ-氧化成Ⅰ2的过程由3步反应组成:
①Ⅰ-(aq)+ O3(g)=ⅠO-(aq)+O2(g)△H1
②ⅠO-(aq)+H+(aq) 
总反应的化学方程式为______,其反应△H=______
(2)在溶液中存在化学平衡:
(3) 为探究Fe2+对氧化Ⅰ-反应的影响(反应体如图13),某研究小组测定两组实验中Ⅰ3-浓度和体系pH,结果见图14和下表。
① Ⅰ组实验中,导致反应后pH升高的原因是_______.
② 图13中的A为_____由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是_______.
③第2组实验进行18s后,Ⅰ3-下降。导致下降的直接原因有双选______.
(4)据图14,计算3-13s内第2组实验中生成l3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
(1)
(2)
(3)①H+被消耗,其浓度降低;②


(4)
解析
本题考查了盖斯定律、化学平衡常数,化学平衡的移动以及化学反应速率的计算等知识。(1)根据题给信息,总反应为O3氧化I-生成I2,将所给的三个反应:①+②+③可得



③c(Fe3+)增加,
v(I3-)=
知识点
请运用化学反应原理的相关知识研究元素及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)═CH3OH(g)△H1=﹣116KJ•mol﹣1
又知:CO(g)+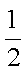
H2(g)+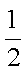
H2(g)+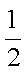
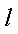
则甲醇的燃烧热为_______。
(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2,5min后达平衡时CH3OH物质的量为2mol,该反应的速率v(H2)为_______;下列措施中有利于增大该反应的反应速率且提高转化率的是_______。
A. 随时将CH3OH与反应混合物分离
B. 降低反应温度
C. 使用高效催化剂
D. 增大体系压强
(3)在密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示。
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA_______tc(填“大于”、“小于’’或“等于“)。
②若A点时容器的体积为10L,该温度下B点的平衡常数K=_______。
(4)Na2SO3的水溶液呈_______(填“酸”、“中”、‘‘碱”)性,原因是(用离子方程式表示):_______;把CaCO3浊液滴入l.0mol/L的Na2SO3溶液中,能否产生CaSO3沉淀?若不能,说明原因;若可行,请简述判断依据及转化过程_______(已知:Ksp(CaSO3)=1.4×10﹣7,Ksp(CaCO3)=2.8×10﹣9)。
正确答案
(1)﹣739kJ•mol﹣1
(2)0.4mol/(L•min)d
(3)①大于 ②1
(4)碱 SO32﹣+H2O⇌HSO3﹣+OH﹣ 可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32﹣)>50c(CO32﹣)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0。1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32﹣)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3⇌Ca2++CO32﹣,向着溶解的方向移动,导致CaCO3溶解。
解析
略。
知识点
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq) 
③HOI(aq) + I-(aq) + H+(aq) 
总反应的化学方程式为________,其反应△H=________。
(2)在溶液中存在化学平衡:I2(aq) + I-(aq) 
(3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
①第1组实验中,导致反应后pH升高的原因是________。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是________。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A. c(H+)减小
B. c(I-)减小
C. I2(g)不断生成
D. c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
(1) O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O,△H=△H1+△H2+△H3。
(2)
(3)反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大;Fe3+,该过程是非氧化还原;BD
(4)(计算过程略)5.5×10—4 mol/L·s
解析
略。
知识点
下列与化学反应能量变化相关的叙述正确的是
正确答案
解析
生成物的总能量低于反应物的总能量,是放热反应,若是吸热反应则相反,故A错;反应速率与反应时放热反应还是吸热反应没有必然的联系,故B错;C是盖斯定律的重要应用,正确;根据△H=生成物的焓-反应物的焓,可知,焓变与反应条件无关,故D错。
知识点
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
a,废弃物的综合利用 b,白色污染的减少 c ,酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___________kg。
正确答案
(1)a,c
(2)消耗溶液中的酸,促进 Al3+和 Fe3+水解生成氢氧化物沉淀
(3)MnO2(s) + SO2(g)=MnSO4(s) ΔH=-248 KJ/mol
(4)Mn2++2H2O - 2e-=MnO2 + 4H+
(5)MnO2 + H2O + e-=MnO(OH) + OH-
(6)
解析
(1)B 中的白色污染主要是由于过度使用塑料引起的
(2)MnCO3 消耗溶液中酸,使 Al3+和 Fe3+的水解反应正向移动,形成氢氧化物沉淀
(3)③—①—②,注意状态、符号
(4)阳极为 Mn2+失电子,电极方程式:Mn2++2H2O - 2e-=MnO2 + 4H+
(5)正极得电子,电极方程式为 MnO2 + H2O + e-=MnO(OH) + OH-
(6)由电子守恒可知,MnO2 中的 Mn 元素只有 3/5 来自 MnSO4,可由数据得到 MnSO4 中 Mn 的量。MnSO4 中的 Mn 元素一部分是 SO2 与 MnO2 反应得来,可由题中数据算出,另一部分来自除杂过程中含Mn 的物质,可根据上诉 Mn 元素守恒求得。再除以 Mn 在 MnO2 中所占质量分数,即可得到答案
知识点
如何降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视。“低碳经济”正成为科学家研究的主要课题。
(1)已知: ① CO(g)+H2O(g)
② C(s)+2H2(g)
③ 2CO(g)
写出CO2与H2反应生成CH4和H2O的热化学方程式 。
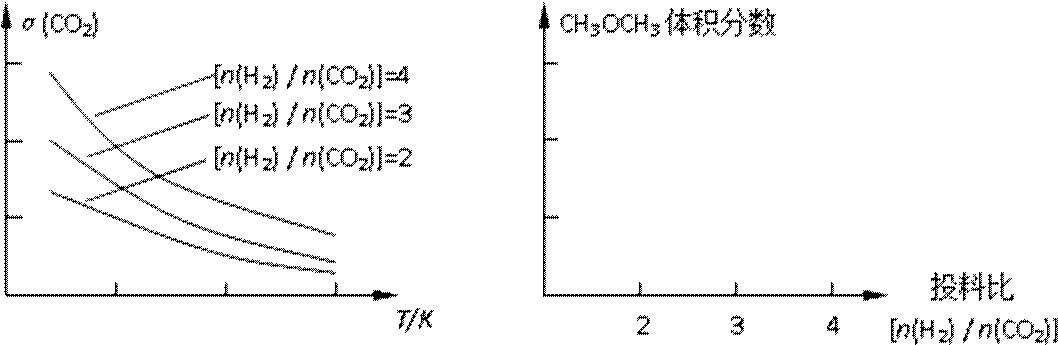
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在下图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
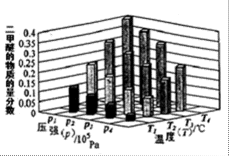
②某温度下,将2.0molCO2(g)和6.0mol(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是 ;
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
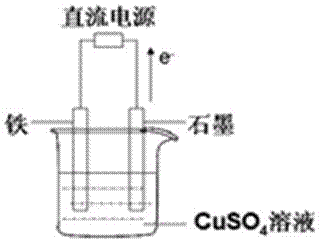
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式____ 。以此燃料电池作为外接电源按右图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。
正确答案
(1)CO2(g)+4H2(g) 
(2) ①画图
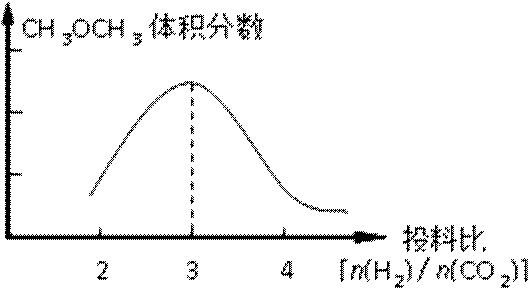
②BD (2分)
③ B (2分)
(3)CH3OH+H2O-6e-=CO2+6H+ (2分)
石墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅(2分),氧化铜(或碳酸铜)(2分),4g(或6.2g)(2分)
解析
略
知识点
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
下列说法正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析