- 用盖斯定律进行有关反应热的计算
- 共44题
8.实现反应CH4(g)+CO2(g)
(1)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0=_________kJ·mol-1
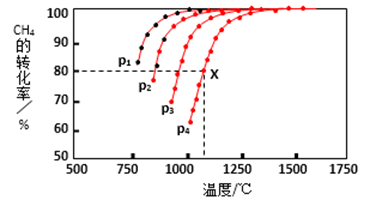
(2)在密闭容器中,通入2.5mol的CH4与2.5molCO2,一定条件下发生反应:CH4(g)+CO2(g)
据图可知,p1、p2、 p3、p4由大到小的顺序_________ 。
(3)CO和H2还可以通过反应C(s)+H2O(g)
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是_________
A.体系压强不再变化
B.CO与H2的物质的量之比为1:1
C.混合气体的密度保持不变
D.每消耗1mol H2O(g)的同时生成1mol H2
② 恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K=_________。
若此时增大压强,平衡将向_________(填“正”、“逆”)反应方向移动,t1min时达到新的平衡。
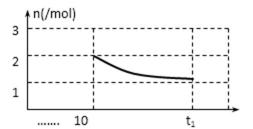
③ 请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图。
正确答案
(1)+248 ;
(2)P4> P3> P2> P1;
(3)① AC;
② 1mol/L;逆
③
解析
解析已在路上飞奔,马上就到!
知识点
10.氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要
的地位、工业制硝酸的主要反应之一是:
(1)如果将4mol NH3 和5mol O2 放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3 的转化率为_______。
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO 的浓度与时间关系如图所示,则NO 的a、b、c 三点的反应速率v(a 正)、v(b 逆)、v(c 正)的大小关系是__________。
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
①第2min 到第4min,反应速率v(O2)= _________;
②第2min 时改变了条件,改变的条件可能是 ______________(从所给选项中选择);
A.降低温度 B.增加了生成物
C.减小压强 D.使用了高效催化剂
③在与第4min 相同的温度下,若起始向容器中加入NH3、O2、NO 和H2O(g)的浓度都为2moI/L,则该反应___________(填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2 可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2 三者等物质的量反应的化学方程式为_________ 。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为( )。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。
回答:0~10 min内,氢气的平均反应速率为( )mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡( )(填“正向”、“逆向”或“不”)移动。
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电电解300mL 某NaCl溶液,正极反应式为( )。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为( )mol。
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3( ) 0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是 ( )(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)( )c(NH3·H2O)。(填“>”、“<”或“=”)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.甲醇(



(I)
(II)
(1)用上述反应中出现过的物质,按下列要求填空:
①分子中有18个电子,该物质的分子式为________;
②具有极性键的非极性分子,该分子的空间构型为 _____________;
(2)甲醇燃料电池是用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入甲醇和氧气。则负极通过_______(填名称),正极上发生的电极反应是________;
(3)已知:
则(I)的热化学方程式
(4)若将甲醇在氧气中完全燃烧,反应的化学方程式为___________;标准状况下,取燃烧所得气体产物2.24升,通过1mol
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.X、Y、Z、W有如图所示的转化关系,已知△H=△H1+△H2,则X、Y可能是( )
①C 、CO ② S、SO2 ③ AlCl3、Al(OH)3 ④Na2CO3、NaHCO3
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析