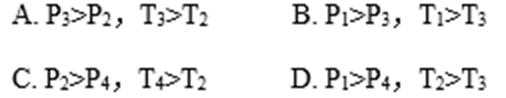- 用盖斯定律进行有关反应热的计算
- 共44题
近两年我国大多城市都受到雾霾天气的影响,雾霾的形成与氮的氧化物和硫的 氧化物有关:
已知:2SO2(g)+O2(g)
2NO(g)+O2(g)
(1)则反应NO2(g)+SO2(g)
(2)某温度时,在一个容积为10L的密闭容器中进行反应①。开始充入4。0 mol SO2和2。0 molO2,半分钟后达到平衡,并放出352。8 kJ的热量。此时SO2的转化率是 ___________,该温度下的平衡常数K=____________。
(3)利用钠碱循环法可脱除工业废气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___________________。
②吸收液吸收SO2的过程中,pH随n(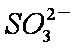
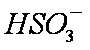
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母)_____________。
a。c(Na+)=2c(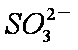
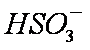
b。c(Na+)>c(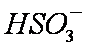
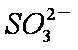
c。c(Na+)+c(H+)=c(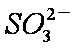
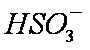
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性, 原因是__________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,所滴加氨水的浓度为_________mol·L-1(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)。
正确答案
(1) —41.8
(2)90% 4050
(3)①2OH-+SO2===H2O+SO ②ab
(4)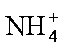

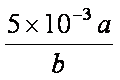
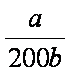
解析
略
知识点
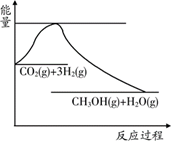
为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g) + 3H2(g)
(1)上图表示该反应过程中能量变化,则该反应为 反应(填“吸热”或“放热”),判断依据是 ;
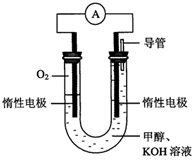
(2)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池正极的电极反应式为: ;
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为: ;
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)为了消除污染,在一定条件下,向含有甲醇的废水中加入一定量的稀硝酸,会有N2等物质生成。若参加反应的氧化剂和还原剂的物质的量之比为6∶5,写出该反应的化学方程式 ;在此反应过程中若消耗32 g 甲醇,将转移
mol 电子。
正确答案
见解析。
解析
(1)放热; 生成物总能量低于反应物总能量 ;
(2) ① O2 + 2H2O + 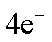
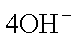
② 2CH3OH + 3O2 + 4KOH = 2K2CO3 + 6H2O ;
(3)CH3OH(l) + O2(g) = CO(g) + 2H2O(l) ΔH =﹣442.8 kJ∕mol ;
(4)5CH3OH + 6HNO3 = 3N2 ↑ + 5CO2 ↑ + 13H2O ; 6 。
知识点
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq) 
③HOI(aq) + I-(aq) + H+(aq) 
总反应的化学方程式为________,其反应△H=________。
(2)在溶液中存在化学平衡:I2(aq) + I-(aq) 
(3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
①第1组实验中,导致反应后pH升高的原因是________。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是________。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A. c(H+)减小
B. c(I-)减小
C. I2(g)不断生成
D. c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
(1) O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O,△H=△H1+△H2+△H3。
(2)
(3)反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大;Fe3+,该过程是非氧化还原;BD
(4)(计算过程略)5.5×10—4 mol/L·s
解析
略。
知识点
如何降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视。“低碳经济”正成为科学家研究的主要课题。
(1)已知: ① CO(g)+H2O(g)
② C(s)+2H2(g)
③ 2CO(g)
写出CO2与H2反应生成CH4和H2O的热化学方程式 。
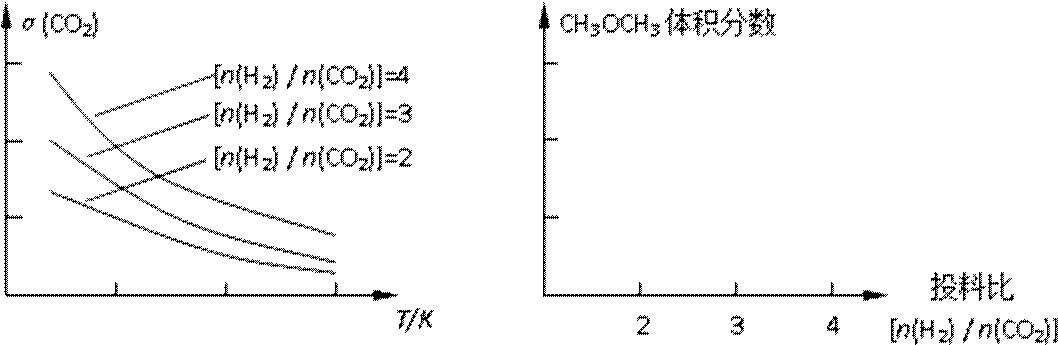
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在下图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
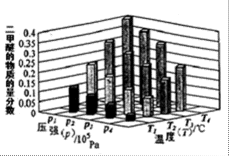
②某温度下,将2.0molCO2(g)和6.0mol(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是 ;
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
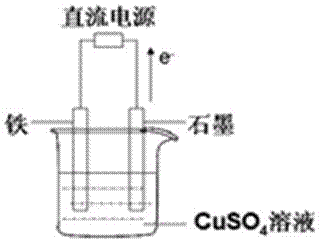
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式____ 。以此燃料电池作为外接电源按右图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。
正确答案
(1)CO2(g)+4H2(g) 
(2) ①画图
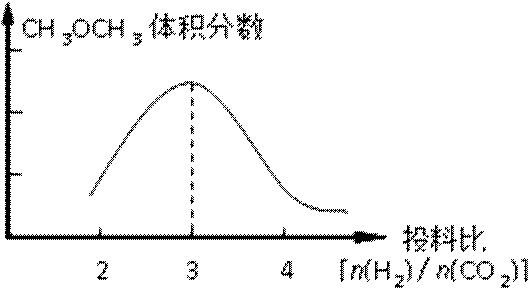
②BD (2分)
③ B (2分)
(3)CH3OH+H2O-6e-=CO2+6H+ (2分)
石墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅(2分),氧化铜(或碳酸铜)(2分),4g(或6.2g)(2分)
解析
略
知识点
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
下列说法正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析