- 人工固氮技术——合成氨
- 共672题

正确答案
解析
解:合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可使平衡向正反应方向移动,则氨气的产率增大,所以沿X路线回去的物质是N2、H2;
故选A.
(2013•成都三模)合成氨工业对国防具有重要意义,如制硝酸、合成纤维以及染料等.
(1)已知某些化学键的键能数据如下表:
合成氨的热化学反应方程式为______.
(2)常温下,向饱和NaCl与饱和氨水的混合溶液中通入过量CO2,有NaHCO3固体析出,该反应的化学方程式为______;所得溶液中离子的电荷守恒式是______;若向饱和NaCl与饱和CO2的混合溶液中通入氨气,则没有NaHCO3固体析出,原因是______.
(3)氨氮废水(含NH3、NaOH和Na2SO4)超标排放会造成水体富营养化.右图通过直接电化学氧化法有效除去某工厂氨气.其中阴离子的流动方向为______(填“向a极”或“向b极”),电解过程中,b极区的pH______(填“增大”或“减小”或“不变”),阳极反应方程式为______.
正确答案
解析
解:(1)△H=反应物总键能-生成物总键能=946KJ/mol+436KJ/mol×3-6×390KJ/mol=-86KJ/mol,
故答案为:-86KJ/mol;
(2)饱和NaCl与饱和氨水的混合溶液中通入过量CO2反应方程式为:NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl;
溶液中阳离子:钠离子、氢离子、铵根离子;阴离子:氯离子、氢氧根离子、碳酸根离子、碳酸氢根离子,依据电荷守恒:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2×c(CO32-)+c(Cl-);二氧化碳在水中的溶解度很小,生成的碳酸氢根离子很少,所以没有碳酸氢钠析出;
故答案为:NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl;c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2×c(CO32-)+c(Cl-);
二氧化碳在水中的溶解度很小,生成的碳酸氢根离子很少,所以没有碳酸氢钠析出;
(3)由电源的连接方式可知,a为电解池的阳极,b为电解池的阴极,电解过程中阴离子移向阳极,阳离子移向阴极,故阴离子移向a;阳极上氨气失去电子被氧化生成氮气电极反应式为:2NH3-6e-+6OH-=N2+6H2O;b极(阴极)上氢离子放电发生还原反应,所以氢离子浓度减小pH值增大,
故答案为:向a极;增大;2NH3-6e-+6OH-=N2+6H2O.
“低碳”既是时尚,也是环保要求.“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式.下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)工艺操作②为:______.
(2)工业合成氨的化学方程式为:______.
(3)副产品的化学式为______.该联合生产工艺中可以循环使用的物质是______.
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______
(5)写出生成“产品”的化学方程式:______.
正确答案
过滤
N2+3H2
CaO
CO2
用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3
CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4
解析
解:(1)该反应原理为:CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4,将沉淀池中的混合物经过滤可得到产品和沉淀,
故答案为:过滤;
(2)工业上用氮气和氢气在高温 高压、催化剂条件下反应生成氨气,反应的化学方程式为:N2+3H2
故答案为:N2+3H2
(3)CaCO3煅烧后可生成CO2和CaO,其中CO2可循环使用,
故答案为:CaO;CO2;
(4)利用湿润的红色石蕊试纸检验NH3,操作方法为:用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3,
故答案为:用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3;
(5)“产品”是(NH4)2SO4,反应物是CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3,反应化学方程式为CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4.

①在第(1)个设备中先把N2、H2压缩的目的是:______.
②在第(3)个设备中用冷却的方法分离出______,其目的是:______.
正确答案
增大压强,使平衡向生成NH3的方向移动
液氨
使平衡右移,提高N2、H2的平衡转化率
解析
解:①第(1)个设备中先把N2和H2压缩,可使压强增大,有利于使平衡向生成氨气的方向移动,
故答案为:增大压强,使平衡向生成NH3的方向移动;
②在第(3)个设备中用冷却方法分离出液氨,生成物浓度降低,可使平衡向正向移动,提高转化率,
故答案为:液氨;使平衡右移,提高N2、H2的平衡转化率.
下列有关工业生产的叙述正确的是( )
正确答案
解析
解:A、合成氨是放热反应,升高温度,不能提高N2、H2的转化率,故A错误;
B、硫酸工业中,加入催化剂平衡不移动,不能提高SO2转化为SO3的转化率,故B错误;
C、电解精炼铜时,阳极是粗铜,精铜作阴极,故C正确;
D、电解饱和食盐水时,阴极室产生的是氢气和氢氧化钠,阳极上产生的是氯气,采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室,故D错误.
故选C.
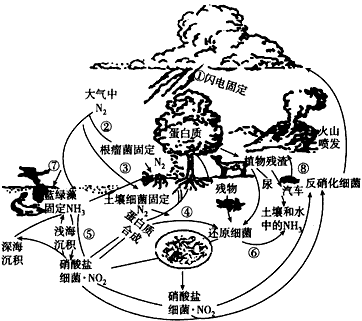
下图是自然界中氮的循环图。请根据图回答下列问题
(1)循环过程中属于氮的固定的是______(填序号)。
(2)日本东京和美国洛杉矶都曾发生过严重的光化学烟雾事件,你认为主要是由于循环图中的过程_______________造成的。
(3)写出过程①所发生的一系列化学反应方程式____________________
(4)如果空气中同时含有较多的二氧化硫,那么,过程①引起的自然灾害是__________________。
(5)深入研究过程②的机理对人工固氮有何积极意义?_______________________
(6)过程⑦在地表上发生时,若人为地造成过程⑦过度的发生,会造成__________________,常见的人为因素有_________________,后果是______________________。
(7)根据氮在自然界中的循环,分析人类在优化氮的循环、减少与之有关的自然灾害过程中可做哪些工作? ________________________
正确答案
(1)①②③⑦
(2)⑧
(3)N2+O2
(4)酸雨
(5)有助于人工仿生固氮的研究
(6)水体富营养化;生活垃圾等高磷、高氮物质向水体中倾倒;水生生物过度繁殖,使水体缺氧
(7)采取可行性措施,防止空气和水污染
化学在工农业生产、科学技术进步等方面有着广泛的应用,对于技术创新有不可低估的影响,请回答下列问题:
(1)工业合成氨需要的原料气是_____________,生产条件是_________________
(2)烧碱生产是海水综合利用的典范,要生产烧碱,首先从海水中获取_________(填写化学式),然后通过___________(填写生产方法)获得该物质,副产物是______________。
(3)化石燃料的综合利用对现代社会的可持续发展有着重要的意义。煤的干馏和石油的分馏这两种生产工 艺在反应本质上的差别为_______________。
(4)下列关于肥料、农药的使用合理的是______________。
a.大量使用肥料和农药以提高粮食的产量
b.使用复合肥料比使用单一肥料更有效
c.肥料的使用只与作物营养状态有关,与土壤的性质无关
d.使用拟除虫菊酯类药物代替有机氯、有机磷农药
正确答案
(1)氮气、氢气(或N2、H2);高温、高压、催化剂
(2)NaCl;电解;Cl2、H2 (3)煤的干馏是化学变化,石油的分馏是物理变化
(4)bd
合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2]Ac+CO+NH3
(1)必须除去原料气中CO的原因是____ 。
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件应是___。
(3)吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力,以供循环使用。醋酸铜氨液再生的生产适宜条件应是___。
正确答案
(1)防止合成塔中的催化剂中毒
(2)低温、高压
(3)高温、低压
合成氨工业中的主要反应是N2+3H2
(1)生产中,采用2×107Pa~3×107 Pa是为了_____________。
(2)加热到500℃,其目的是___________。
(3)使用催化剂是为了_____________。
(4)采用循环操作是为了_____________。
(5)若反应容器的体积不变,并维持原反应温度,而将平衡体系中的混合气体浓度增大一倍,则上述平衡向___________方向移动,原因是______________。
正确答案
(1)提高反应速率及氨的产率
(2)该温度时,催化剂的活性最高
(3)提高反应速率,缩短达到平衡所需的时间
(4)提高原料(N2、H2)的利用率
(5)正反应 ;增大浓度,相当于增大压强
合成氨工业、硫酸工业的生产工艺流程大致为
合成塔和接触室中的反应分别为:
N2(g)+3H2(g)
2SO2(g)+O2( g)
(1)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是____________。
(2)采用循环操作可提高原料的利用率,下列工业生产中,采用循环操作的是_______(填写序号)。
①硫酸工业②合成氨工业③硝酸工业
(3)根据化学平衡移动原理来确定的条件或措施有________(填写序号)。
①合成氨工业在高压下进行
②合成氨工业和硫酸工业都使用催化剂
③合成氨工业和硫酸工业都使用适宜的温度
④硫酸工业中,净化后的炉气中要有过量的空气
⑤及时将氨液化而分离
⑥吸收塔中用98.3%的浓硫酸吸收SO3
⑦硫酸工业的催化氧化在常压下进行
(4)工业生产中常用氨--酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业的尾气中含有
SO2,直接排放到空气中会造成环境污染,引起的后果是_____________,处理该尾气可以得到一种化肥,写出该肥料的化学式________。
正确答案
(1)充分利用反应中放出的热量加热反应气
(2)①②③
(3)①③④⑤
(4)形成酸雨;(NH4)2SO4
扫码查看完整答案与解析