- 镁、铝的重要化合物
- 共20题
20.已知NaOH+Al(OH)3→Na[Al(OH)4]。向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是
正确答案
解析
向集满CO2的铝罐中加入过量氢氧化钠,首先CO2与氢氧化钠反应,表现为铝罐变瘪,接着过量的氢氧化钠再与铝罐反应,因铝罐表面有氧化膜Al2O3,故可发生A、B、C的反应。故选D。
考查方向
解题思路
铝及表面有氧化膜Al2O3和氢氧化钠溶液反应过程中不会有Al3+产生。
易错点
未熟练掌握Al、Al2O3的性质。
知识点
29.(15分)无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:

步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
正确答案
(1)干燥管 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应
(2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患
(3)镁屑
(4)BD
(5)①从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次
②97.5%
知识点
4.下列离子方程式正确的是
正确答案
解析
A.烧碱溶液与铝片反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,所以A错误;B.将磁性氧化铁溶于盐酸的离子反应为Fe3O4+8H+=2Fe3++Fe2++4H2O,所以B错误;C.用惰性电极电解氯化钠时,在两极上分别产生氢气和氯气,而用铁做电极,则阳极上是铁放电,故而没有氯气生成,反应的离子方程式为:Fe+2H2O
考查方向
解题思路
A.烧碱溶液与铝片反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑B.将磁性氧化铁溶于盐酸的离子反应为Fe3O4+8H+=2Fe3++Fe2++4H2O,C.用惰性电极电解氯化钠时,在两极上分别产生氢气和氯气,而用铁做电极,则阳极上是铁放电,故而没有氯气生成;D.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合,反应生成了碳酸钡、一水合氨和水。
易错点
盐酸没有强氧化性,不能将Fe2+氧化为Fe3+电解过程中活泼金属做阳极要比阴离子优先放电;
知识点
16.室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.下列物质的转化在给定条件下能实现的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
3.下列实验操作能达到目的的是( )
正确答案
解析
A.工业上用Na2CO3溶液浸泡锅炉水垢使其中CaSO4能转化为CaCO3,碳酸钙不溶于水,故A错误;
B.淀粉在稀硫酸作用下水解生成葡萄糖,加NaOH溶液中和稀硫酸,使混合液呈碱性,然后加入银氨溶液,有单质银生成可检验产物葡萄糖,证明淀粉已水解,反之,淀粉未水解;由于淀粉遇碘单质变蓝,所以向水解后的溶液加碘水如果变蓝,则说明淀粉水解不完全,反之,淀粉已完全水解,故B正确;
C.检验溴离子应在酸性溶液中,则水解后、冷却加酸至酸性,再滴加硝酸银溶液来检验卤素的种类,故C错误;
D.水的体积不等于溶液的体积,应加水至溶液的体积等于100mL,故D错误
考查方向
本题考查化学实验方案的评价
解题思路
A.工业上用Na2CO3溶液浸泡锅炉水垢使其中CaSO4能转化为CaCO3;
B.淀粉遇碘单质变蓝来验证淀粉的存在;
C.检验溴离子应在酸性溶液中;
D.水的体积不等于溶液的体积
易错点
C项中卤代烃的消去反应是在NaOH的醇溶液中发生的,需先加入酸中和后滴加AgNO3溶液检验
教师点评
本题考查化学实验方案的评价,在近几年的各省高考题中出现的频率非常高,常与沉淀的生成与转化、酸性比较、非金属性比较、氧化还原反应、离子的检验等知识点交汇命题
知识点
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①反应
②Al4C3是反应过程的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式 。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6.0mol·L-1HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为 。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,
混合物Y均只能部分放出氢气,反应后残留固体物质X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是
(填化学式)。
(3)铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如右下图所示。该电池反应的化学方程式为: 。
正确答案
见解析。
解析
(1)①a+b
②Al4C3+12HCl=4AlCl3+3CH4↑
(2)①防止Mg Al被空气氧化
②52 mol
③Al
(3)2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O
本题以新能源、新材料为背景涉及元素化合物性质、热化学方程式和电极反应方程式的书写、读图读表计算与分析的综合题,是以常见物质相关的化学知识在生产、生活中具体运用的典型试题。
知识点
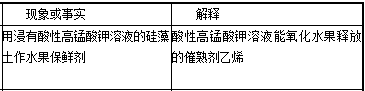
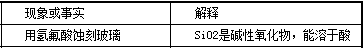
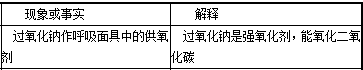
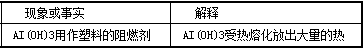
1.化学与社会、生活密切相关。对下列现象或事实的解释正确的是
正确答案
解析
A.化铝受热分解生成水,并吸收大量的热,是周围环境温度降低,且生成的氧化铝熔点高,附着在可燃物表面,从而阻止可燃物燃烧,故A错误
B. 二氧化硅是酸性氧化物,常温下能够与氢氟酸反应,故B错误
C. 过氧化钠与二氧化碳反应,生成碳酸钠和氧气,过氧化钠既作氧化剂又做还原剂,故C错误
D. 乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,乙烯含有不饱和键能被高锰酸钾氧化,故D正确。
故本题选D。
考查方向
解题思路
A.氢氧化铝受热分解生成水,并吸收大量的热,是周围环境温度降低
B.二氧化硅是酸性氧化物,常温下能够与氢氟酸反应
C.过氧化钠与二氧化碳反应,生成碳酸钠和氧气,过氧化钠既作氧化剂又做还原剂
D.乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用
易错点
过氧化钠用于呼吸面具中作为氧气的来源,反应中过氧化钠既作氧化剂又做还原剂
知识点
扫码查看完整答案与解析