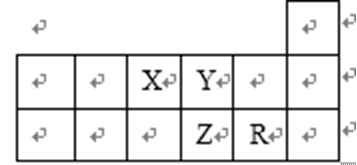- 元素周期律的应用
- 共230题
4. 短周期元素X、Y、Z、R在周期表中的位置如图。下列说法正确的是()
正确答案
解析
略
知识点
7.Q、W、X、Y、Z都是短周期元素。X、Y、Q在周期表中的位置关系如图。W、Z的最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是()
正确答案
解析
略
知识点
X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期原子半径最大的元素,N是地壳中含量最高的金属元素。
用化学用语回答下列问题:
(1)M在元素周期表中的位置为_____________;六种元素的原子半径从大到小的顺序是_____________
(2)Z、X两元素按原子数目比l∶3构成分子A, A的电子式为_____________
Y、L两元素按原子数目比l∶2构成分子B,B中所含的化学键类型为_____________
(3)硒(se)是人体必需的微量元素,已知非金属性:34Se<L。请结合原子结构解释原因
(4)用Y、L、M构成的正盐溶液可以清除油污,请结合离子方程式以及必要的文字解释原因
(5)用石墨作电极,NCl3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出电解熔融Q制取N的电极方程式:
阳极:_____________;阴极:_____________。
正确答案
见解析。
解析
(1)第三周期、第ⅠA族;Na>Al>C>N>O>H
(2)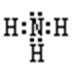
(3)O和Se同族,原子半径依次增大,导致得电子能力减弱,所以非金属性减弱。
(4) CO32- + H2O 
(5)2O2--4e-=O2↑,Al3+ +3e-=Al
知识点
9.A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下阁为相互转 化关系:
谘回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出工业上制取A反应的离子方程式_______________
(3)戊的分子式为_______.B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________
(5)8gE在A中燃烧放山热摄QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
正确答案
(1)
(2)MnO2 + 4H+ + 2Cl― △ Mn2+ + Cl2↑ + 2H2O
(3)HClO
(4)
(5)2Fe(s) + 3Cl2(g) 点燃 FeCl3(s),△H = -14 Q kJ·mol-1
(6)向盐酸中加入适量的FeCl2晶体,搅拌溶解,然后加水稀释,并加入少许铁粉。
解析
略
知识点
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,由此可知( )。
正确答案
解析
略
知识点
扫码查看完整答案与解析