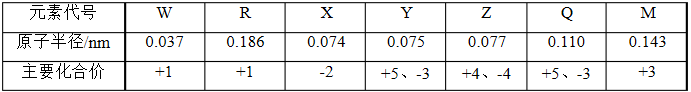- 元素周期律的应用
- 共230题
下表是部分短周期元素的原子半径和主要化合价。
用化学用语回答:
(1)七种元素中原子半径最大的元素在周期表中的位置 ,M的单质与R的最高价氧化物对应的水化物发生反应的化学方程式为 。
(2)X可与R按1:1的原子个数比形成化合物甲,甲中存在的化学键类型有 ,X可与W组成含18电子的化合物乙,则乙的电子式为 。
(3)Y的氢化物比Q的氢化物稳定的根本原因 。
正确答案
见解析。
解析
(1)第三周期 ⅠA族
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2)离子键、共价键或非极性共价键
(3)氮的非金属性比磷的强
知识点
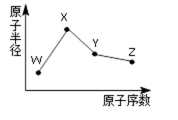
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右下图。已知W
的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是
一种常见的半导体材料;Z的非金属性在同周期元素 中最强。下列说法正确的是
正确答案
解析
略
知识点
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
正确答案
解析
略
知识点
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍。下列说法不正确的是
正确答案
解析
略。
知识点
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B在元素周期表中的位置 ,写出E2D的电子式 。
(2)写出A与D形成的10电子阳离子的化学式 。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是 。
(4)常温下,1molA的单质在D的单质中完全燃烧生成液态水,放出286kJ的热量,写出该反应的热化学方程式 。
正确答案
见解析。
解析
(1) 第二周期 ⅣA族
(2) H3O+
(3) S2->Cl->Na+
(4) H2(g) + 1/2O2(g) === H2O(l) △H=-286kJ·mol-1
知识点
扫码查看完整答案与解析