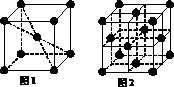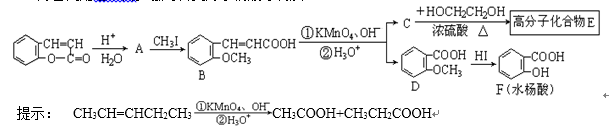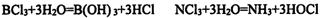- 判断简单分子或离子的构型
- 共22题
28、29题为物理题,第30、31题为化学题,考生从两道物理题、化学题中各任选一题作答。
30.[化学---物质结构与性质]
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)P、S、Cl三种元素中,第一电离能最小的是( ) 。
(2)PCl3和CH4中心原子的杂化类型相同,PCl3分子的空间构型是( ) 。
(3)钛原子的电子排布式为 ( ) 。在浓的TiCl3溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,将1 mol该物质溶于水,加入足量硝酸银溶液,立即产生1 mol氯化银沉淀,则该配合物阳离子的化学式为 ( ),形成该离子时提供孤电子对的分子或离子是( ) (填化学式)。
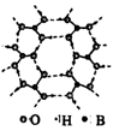
(4)铁元素在1183 K以下形成的晶体的基本结构
单元如图1所示,1183 K以上转变为图2所示结构的
基本结构单元。两种晶体的基本结构单元中的原子个
数之比为( ) 。
31.[化学---有机化学基础]
香豆素是广泛存在于植物中的一类芳香族化合物,具有抗菌和消炎作用。它的核心结构是芳香内酯,其结构简式为
(1)下列关于芳香内酯的叙述正确的是( ) 。
A.分子式为C9H8O2 B.可发生加聚反应
C.能与溴水发生反应 D.1mol芳香内酯最多能和5mol氢气发生加成反应
(2)写出芳香内酯在酸性条件下水解的化学方程式:( )。
(3)芳香内酯经下列步骤可转变为水杨酸等物质:
请回答下列问题:
① 指出D → F的反应类型为( ) 。
② 请写出反应C → E的化学方程式:( ) 。
③在一定条件下阿司匹林(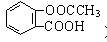
a.三氯化铁溶液 b.碳酸氢钠溶液 c.石蕊试液 d.氢氧化钠溶液
④水杨酸的同分异构体中含有酚羟基且属于酯类的共有3种,写出其中一种同分异构体的结构简式( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
第29、30题为物理题,第31、32题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
31.[化学——物质结构与性质]
由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态Cu+的核外电子排布式为___________。高温下CuO能转化为Cu2O,试从原子结构角度解释其原因:_______________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于___________晶体。
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过
反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3而制得。
①与上述化学方程式有关的叙述不平碜的是——(填标号)。
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1 mol(HB=NH)3分子中有_________mol
(4)在硼酸盐中,阴离子有链状、立体状等多种结构形式。图(a)是一种长链结构的硼酸根,则该硼酸根离子的化学符号为_________。图(b)是硼砂晶体中阴离子的立体状结构,
其中硼原子采取的杂化轨道类型有__________________。
32.[化学一有机化学基础]
甲苯是一种重要的化工原料。以甲苯为原料通过以下转化可得多种化工产品。
(1)写出指定物质的结构简式:A______________,M______________。
(2)C中苯环上的侧链所含官能团的名称是_______________________。
(3)E→F的反应类型是______________。
(4)关于B的说法正确的是__________(填标号)。
a.能发生银镜反应 b.遇FeCl3溶液发生显色反应
c.能发生消去反应 d.能与H2发生加成反应
(5)写出D→E反应的化学方程式:_______________________。
(6)写出符合下列条件的A的同分异构体的结构简式:__________________。
a.苯环上一氯代物只有3种
b.不能与新制氢氧化铜悬浊液反应

甲苯是一种重要的化工原料。以甲苯为原料通过以下转化可得多种化工产品。

(2)C中苯环上的侧链所含官能团的名称是_______________________。
(3)E→F的反应类型是______________。
(4)关于B的说法正确的是__________(填标号)。
a.能发生银镜反应 b.遇FeCl3溶液发生显色反应
c.能发生消去反应 d.能与H2发生加成反应
(5)写出D→E反应的化学方程式:_______________________。
(6)写出符合下列条件的A的同分异构体的结构简式:__________________。
a.苯环上一氯代物只有3种
b.不能与新制氢氧化铜悬浊液反应
正确答案
第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
30.【化学——物质结构与性质】
(1)下列分子中,属于平面型构型的有________。
A.CCl4 B.PH3 C.BBr3 D.COCl2
(2)H2O分子间因存在“氢键”的作用而彼此结合形成(H2O)n。在该分子形成的晶体中每个H2O分子被4个H2O分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图所示,试填空。
①含1molH2O的该晶体中有_____个“氢键”。
②请说明H2O比H2S的沸点高的原因___________________。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子的价电子排布式为________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是_______;
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为________。
31.【化学——有机化学基础】A、B、C、D、E均为有机物,它们具有下图的转化关系:
已知:C能与NaHCO3发生反应,C、D相对分子质量相等,E能发生银镜反应,相对分子质量为74。
请回答下列问题:
(1)写出C的名称:( ),E中含有的官能团名称( )、( );
写出有机物B可能发生的两种反应类型:( );
(2)写出反应②的化学方程式:( );
(3)A的结构简式为( );
(4)写出两种同时符合下列条件的B的同分异构体的结构简式:( ) 、( )。
①苯环上有二个间位取代基; ②属于芳香酸酯; ③能与FeCl3显色
30.【化学——物质结构与性质】
(1)下列分子中,属于平面型构型的有________。

已知:C能与NaHCO3发生反应,C、D相对分子质量相等,E能发生银镜反应,相对分子质量为74。
请回答下列问题:
(1)写出C的名称: ,E中含有的官能团名称 、 ;
写出有机物B可能发生的两种反应类型: ;
(2)写出反应②的化学方程式: ;
(3)A的结构简式为 ;
(4)写出两种同时符合下列条件的B的同分异构体的结构简式: 、 。
①苯环上有二个间位取代基; ②属于芳香酸酯; ③能与FeCl3显色
正确答案
正确答案
第29、30题为物理题,第31、32题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
31.[化学——物质结构与性质]
物质结构决定物质的性质,物质性质反映了物质结构。
(1)BCl3、NCl3与水反应化学方程式如下:
分析上述反应,判断B、N、Cl三种元素的电负性由大到小的顺序是____。上述两个反应所含的微粒中,呈三角锥形的是( )(填化学式)
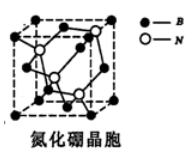
(2) BN是一种新型无机非金属材料,熔点很高、硬度很大,
晶胞结构如图。BN晶体中存在的作用力有____(填选项)。
A.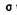
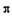
C.配位键 D.分子间作用力
(3)B(OH)3的晶体结构如图所示。晶体中B原子的轨道杂化方
式是 ;B(OH)3可能具有的性质是( )(填选项)。
A.能溶于水 B.熔点很高
C.能形成
E.熔化状态下能导电
(4)还原铁粉可作为合成氨的触媒。基态Fe原子的核外有( )个,
未成对电子。从原子结构的角度分析,二价铁易被氧化为三价铁的
原因是____。
32.[化学——有机化学基础]
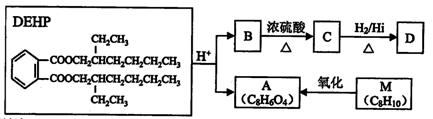
增塑剂(又称塑化剂)是工业上使用的塑料添加剂,但严禁用于食品。塑料增塑剂DEHP有如下的转化关系:
完成下列填空:
(1)用系统命名法命名D:( ),B分子中所含官能团的名称为 ( ),
(2)B—C的反应类型为( ) 。
(3)①关于A的下列说法正确的是 ( )(填选项)
A.属于芳香烃 B.能发生加成反应和取代反应
C.不能与碳酸钠溶液反应 D. M~A可用酸性高锰酸钾溶液做氧化剂
②A的一种同分异构体Q具有下列特征:
a.是苯的邻位二元取代物b.遇氯化铁溶液显紫色c.能与碳酸氢钠溶液反应
写出Q的结构简式为( )。
(4)写出DEHP在酸性介质中水解的化学反应方程式( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C第一电离能大小顺序( );基态D原子的价电子排布式为( ) 。
(2)A的最高价氧化物对应的水化物分子中,其中心的A原子采取( ) 杂化;BC3-的空间构型为 ( ) 。
(3)1 molAB-中含有的
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,
则该合金中Ca和D的原子个数比是( ) 。
(5)镧镍合金与上述合金晶胞结构相同,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH1.5合金(氢进入晶胞空隙,体积不变),则氢在合金中的密度为 ( ) g/cm3。(保留小数点后三位数字)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析