- 电解质在水溶液中的电离
- 共39题
20.某溶液中可能存在Br-.CO32-.SO32-.Al3+.I-.Mg2+.Na+ .K+等8种离子中的某几种。取该溶液进行实验,得到如下现象:①向溶液中滴加过量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中存在的离子组可能是
正确答案
解析
①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有无色气泡冒出,说明溶液中含离子CO32-;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,可能是碘离子氧化成单质碘,进一步单质碘被氧化成碘酸根离子或溶液中不含I-,所以溶液不变色,不能确定碘离子存在;
溶液中含有CO32-,则一定不含有Al3+、Mg2+,因与CO32-反应生成沉淀,
根据溶液呈电中性原则,溶液中一定含有Na+或K+,
所以溶液中一定不存在的离子为Al3+、Mg2+、SO32-,
该溶液中存在的离子组可能是CO32-、Br-、Na+或K+、CO32-、I-,
考查方向
常见离子的检验
解题思路
①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有无色气泡冒出,说明溶液中含离子CO32-;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,可能是碘离子氧化成单质碘,进一步单质碘被氧化成碘酸根离子或溶液中不含I-,所以溶液不变色,不能确定碘离子存在,以此来解答
易错点
滴加淀粉溶液,溶液不变蓝色,可能是碘离子氧化成单质碘,进一步单质碘被氧化成碘酸根离子或溶液中不含I-
教师点评
题考查常见离子的检验,为高频考点,把握常见离子之间的反应、离子共存、溶液为电中性为解答的关键,侧重分析与推断能力的综合考查,充分考查了学生灵活应用基础知识的能力,题目难度不大
知识点
氮及其化合物在生产生活中有广泛应用。
23.已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g)
反应Ⅱ:4CO(g)+2NO2(g)

写出CO将NO2还原为NO的热化学方程式 。
2、解析化学平衡移动题目的一般思路
改变条件
3. 分析电解过程的思维程序
(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。
(3)然后排出阴、阳两极的放电顺序
阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。
注意 ①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。②最常用、最重要的放电顺序是:阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后写出电解反应的总化学方程式或离子方程式。
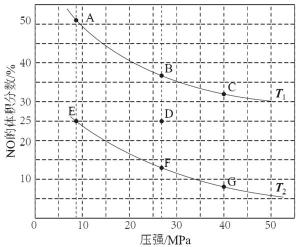
24.在密闭容器中充入5 mol CO和4 mol NO,发生上述反应I,下图为平衡时NO的
体积分数与温度、压强的关系。
回答下列问题:
①温度:T1 T2(填“<”或“>”)。
②某温度下,在体积为2 L的密闭容器中,反应进行10分钟放出热量373 kJ,用CO的浓度变化表示的平均反应速率v(CO)= 。
③某温度下,反应达到平衡状态D点时,容器体积为2 L,此时的平衡常数K =
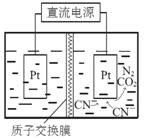
26.如图,在酸性条件下,电解水中CN-可转化为CO2和N2,请写出阳极的电极反应式 。
正确答案
CO(g)+NO2(g)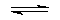
解析
首先根据题意写出化学方程式:CO(g)+NO2(g)
与题干中的两个热化学方程式比较,发现此反应中没有N2,即:2CO(g)+2NO(g)
4CO(g)+2NO2(g)

可以得出 △H= (△H2- △H1)/2=227.5
考查方向
盖斯定律的应用
解题思路
首先根据题意写出化学方程式:CO(g)+NO2(g)
与题干中的两个热化学方程式比较,发现此反应中没有N2,即:2CO(g)+2NO(g)
4CO(g)+2NO2(g)

可以得出 △H= (△H2- △H1)/2=227.5
易错点
盖斯定律的应用要学会消元法,不准确得到目标方程式,容易出错。
教师点评
考察盖斯定律的好题。
正确答案
2、解析化学平衡移动题目的一般思路
改变条件
解析
找准条件,运用勒夏特列原理解答。
考查方向
化学平衡移动题目的一般思路
解题思路
找准条件,运用勒夏特列原理解答。
易错点
隐含条件容易忽略。
教师点评
找准方向
正确答案
3. 分析电解过程的思维程序
(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。
(3)然后排出阴、阳两极的放电顺序
阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。
注意 ①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。②最常用、最重要的放电顺序是:阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后写出电解反应的总化学方程式或离子方程式。
解析
3. 分析电解过程的思维程序
(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。
(3)然后排出阴、阳两极的放电顺序
阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。
注意 ①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。②最常用、最重要的放电顺序是:阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后写出电解反应的总化学方程式或离子方程式。
考查方向
分析电解过程
解题思路
3. 分析电解过程的思维程序
(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。
(3)然后排出阴、阳两极的放电顺序
阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。
注意 ①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。②最常用、最重要的放电顺序是:阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后写出电解反应的总化学方程式或离子方程式。
易错点
放电顺序要理解运用。
教师点评
放电顺序要理解运用。
正确答案
①>;②0.05 mol·L-1·min-1;③0.22 L·mol-1;A。
解析
(1) 因为反应Ⅰ:2CO(g)+2NO(g)
(2) 消耗的n(CO)=(373/746)*2mol,V=△c/△t=(373/746)*2mol/(2L*10)=0.05 mol·L-1·min-1;
(3) 2CO(g)+2NO(g)
起始 5mol 4mol 0 0
转化 x x x/2 x
平衡 5-x 4-x x/2 x
w(NO)=( 4-x)/(5-x+4-x + x/2 +x)=0.25
得出x=2mol,分别求出各物质浓度,再代入平衡表达式即可
得K=0.22 L·mol-1
考查方向
平衡移动原理的应用
解题思路
(1) 因为反应Ⅰ:2CO(g)+2NO(g)
(2) 消耗的n(CO)=(373/746)*2mol,V=△c/△t=(373/746)*2mol/(2L*10)=0.05 mol·L-1·min-1;
(3) 2CO(g)+2NO(g)
起始 5mol 4mol 0 0
转化 x x x/2 x
平衡 5-x 4-x x/2 x
w(NO)=( 4-x)/(5-x+4-x + x/2 +x)=0.25
得出x=2mol,分别求出各物质浓度,再代入平衡表达式即可
得K=0.22 L·mol-1
易错点
要先根据三段式求各物质浓度。
教师点评
要先根据三段式求各物质浓度,属于较难题了。
正确答案
2CN-+4H2O-10e-=N2↑+2CO2↑+8H+
解析
阳极失去电子,化合价升高,结合题干很容易得出2CN--10e-=N2↑+2CO2↑,注意CN-中N化合价是-3,C的化合价是+2.
根据电荷守恒得知右边还差10个正电荷(电子带负电),所以在右边加10H+,得出答案:2CN-+4H2O-10e-=N2↑+2CO2↑+8H+
考查方向
电极反应式的书写。
解题思路
阳极失去电子,化合价升高,结合题干很容易得出2CN--10e-=N2↑+2CO2↑,注意CN-中N化合价是-3,C的化合价是+2.
根据电荷守恒得知右边还差10个正电荷(电子带负电),所以在右边加10H+,得出答案:2CN-+4H2O-10e-=N2↑+2CO2↑+8H+
易错点
电极反应式的书写要注意溶液的酸碱性。
教师点评
结合实际生产,考察学生对电解原理的理解。
6.一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg
正确答案
解析
根据电池反应式知,放电时为原电池反应,Mg失电子发生氧化反应,则Mg是负极,电极反应式为Mg-2e-=Mg2+,Fe3S4为正极,正极反应式为Fe3S4+8e-=3Fe+4S2-,
A.通过以上分析知,Mg失电子发生氧化反应,则Mg是负极,故A正确;
B.放电时,Fe3S4为正极,正极反应式为Fe3S4+8e-=3Fe+4S2-,故B正确;
C.充电时,原电池的负极与电源的负极连接,发生还原反应,阴极的电极反应式为MgS+2e-=Mg+S2-,故C正确;
D.原电池的负极与电源的负极连接,原电池的正极与电源的正极相连,则左侧为阳极,右侧为阴极,充电时,S2-应移向阳极即从阴离子交换膜右侧向左侧迁移,故D错误
考查方向
原电池和电解池的工作原理
解题思路
根据电池反应式知,放电时为原电池反应,Mg失电子发生氧化反应,则Mg是负极,电极反应式为Mg-2e-=Mg2+,Fe3S4为正极,正极反应式为Fe3S4+8e-=3Fe+4S2-,充电时,原电池的负极与电源的负极连接,发生还原反应,原电池的正极与电源的正极相连,发生氧化反应,结合电极方程式解答该题
易错点
电极反应式的书写
教师点评
本题考查化学电源新型电池,为高考高频点,明确原电池中元素化合价变化与电极正负极关系,难点是电极反应式的书写,题目难度中等
知识点
7. 30℃时,利用右图装置进行实验,结果记录如下表所示:
下列说法不正确的是( )
正确答案
解析
A.Ⅱ中铝比铁活泼,铝与稀硫酸反应生成氢气,其电极反应是:Al-3e-═Al3+,故A正确;
B.Ⅱ中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行,故B正确;
C.Ⅳ中Fe溶解,为负极,发生了氧化反应,故C正确;
D.上述实验表明:相同条件下,Al在浓HNO3中更稳定,Fe在浓H2SO4中更稳定,故D错误
考查方向
原电池工作原理
解题思路
A.Ⅱ中铝比铁活泼,铝与稀硫酸反应生成氢气,其电极反应是:Al-3e-═Al3+;
B.Ⅱ中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行;
C.Ⅳ中Fe溶解,为负极,发生了氧化反应;
D.上述实验表明:相同条件下,Al在浓HNO3中更稳定,Fe在浓H2SO4中更稳定
易错点
实验I、Ⅱ中检流表偏转方向与原电池的正负极对应关系在实验Ⅲ、Ⅳ中应用
教师点评
本题考查原电池工作原理,为高频考点,题目难度中等,侧重于学生的分析能力的考查,明确原电池工作原理,注意掌握原电池的工作原理以及电极方程式的书写方法
知识点
扫码查看完整答案与解析