- 金属冶炼的一般原理
- 共29题
12.在铁质品上镀上一定厚度的锌层,以下电镀方案正确的是( )
正确答案
解析
在Fe上镀上一定厚度的锌层,镀层作阳极、镀件作阴极,含有镀层金属阳离子的可溶性盐溶液为电解质溶液,所以Zn作阳极、Fe作阴极,含有锌离子可溶性盐为电解质
考查方向
电化学
解题思路
在Fe上镀上一定厚度的锌层,镀层作阳极、镀件作阴极,含有镀层金属阳离子的可溶性盐溶液为电解质溶液,据此分析解答
易错点
电镀池的基本构成条件
教师点评
本题考查电镀,为高频考点,把握阴阳极、电解质判断方法是解本题关键,电镀也属于电解,题目难度不大
知识点
1.下列有关金属及其化合物的说法正确的是
正确答案
解析
A.常见金属的冶炼方法有电解法、热还原法、热分解法等,其中Mg和Al都为活泼金属,应用电解法冶炼,故A正确;
B.铁和水蒸气在高温下反应生成四氧化三铁,不生成碱,故B错误;
C.Cu常温下与浓硝酸反应生成二氧化氮,Fe常温下在浓硝酸中钝化,故C错误;
D.Na2O和CO2反应生成碳酸钠,Na2O2与CO2反应除生成碳酸钠外,还有氧气,故D错误
考查方向
金属元素及其化合物的性质
解题思路
A.Mg和Al都为活泼金属,应用电解法冶炼;
B.铁和水蒸气在高温下反应生成四氧化三铁;
C.Cu常温下与浓硝酸反应,Fe常温下在浓硝酸中钝化;
D.Na2O和CO2反应生成碳酸钠,Na2O2与CO2反应生成碳酸钠和氧气
易错点
B项:铁和水蒸气在高温下反应不生成碱
教师点评
本题考查较为综合,涉及钠、镁、铝、铁等金属单质及其化合物的性质,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大
知识点
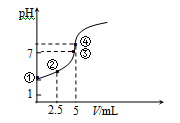
4.常温下向10 mL 0.1 mol·L-1 HN3(叠氮酸)溶液中逐滴滴加0.2 mol·L-1的NaOH溶液,
溶液pH的变化曲线如右下图所示(溶液混合时体积的变化、温度忽略不计,HN3的
Ka=10-4.7)。下列说法不正确的是( )
正确答案
解析
A、①点溶液显示酸性,叠氮酸量较多,所以水的电离受到抑制,③点溶液显示中性,水的电离不受影响,所以水电离出的c(OH-):①点小于③点,故A正确;
B、HN3(叠氮酸)溶液中逐滴滴加NaOH溶液,由于叠氮酸属于弱酸,所以不能用甲基橙做指示剂,应该使用酚酞,故B错误;
C、向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液2.5mL,此时得到的是叠氮酸和叠氮酸钠的混合液,溶液显示酸性,叠氮酸的电离程度大于叠氮酸根离子的水解程度,存在:c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-),故C正确;
D、向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液5mL,此时二者恰好反应,得到叠氮酸钠溶液,溶液显示碱性存在物料守恒:c(Na+)=c(N3-)+c(HN3)=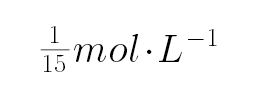
考查方向
本题考查了酸碱混合的定性判断、溶液pH计算、离子浓度大小比较
解题思路
A、根据图示信息,结合溶液的酸碱性判断水的电离程度;
B、HN3(叠氮酸)溶液中滴加NaOH溶液,根据叠氮酸属于弱酸来判断;
C、向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液2.5mL,此时得到的是叠氮酸和叠氮酸钠的混合液;
D、向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液5mL,此时二者恰好反应,得到叠氮酸钠溶液,根据物料守恒来计算.
易错点
图象曲线中各点的对应溶质组成
教师点评
本题考查了酸碱混合的定性判断、溶液pH计算、离子浓度大小比较,在近几年的各省高考题中出现的频率较高,常与盐类水解、弱电解质电离、pH计算等知识交汇命题
知识点
2.在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及其硫酸盐的信息,用以证明火星上存在或曾经存在过水,以下叙述正确的是
正确答案
解析
A.Fe2O3与Fe3O4不互为同素异形体,它们不是单质,故A错误
B. 步骤为:样品→粉碎→加稀盐酸溶解→过滤 →向滤液中滴加KSCN溶液,故B错误
C. 将CO2通入BaCl2溶液中至饱和,最终会生成碳酸氢钡,无沉淀生成,故C错误
D. 铝的制备电解氧化铝,而Fe、Cu用还原剂还原,故D正确
故题选择D
考查方向
解题思路
A.Fe2O3与Fe3O4不互为同素异形体,它们不是单质。
B. 步骤为:样品→粉碎→加稀盐酸溶解→过滤 →向滤液中滴加KSCN溶液
C. 将CO2通入BaCl2溶液中至饱和,最终会生成碳酸氢钡,无沉淀生成
D. 铝的制备电解氧化铝,而Fe、Cu用还原剂还原
易错点
将CO2通入BaCl2溶液中至饱和,只考虑到有碳酸钡生成
知识点
扫码查看完整答案与解析