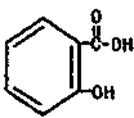
- 化学键与物质的性质
- 共213题
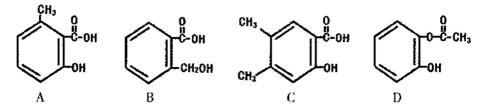
11. M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。
(1)M原子的外围电子排布式为_____________________,在周期表中属于 区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为______(填序号)。
(3)MCl3·6H2O有三种不同颜色的异构体:
A.[M(H2O)6]Cl3,
B.[M(H2O)5Cl]Cl2·H2O
C.[M(H2O)4Cl2]Cl·2H2O。
为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.010 mol MCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为__________ (填A或B或C)。
(4)MO2Cl2常温下为暗红色液体,熔点-96.5℃,沸点117℃,能与丙酮(CH3COCH3).CCl4.CS2等互溶。
①固态MO2Cl2属于_________晶体;
②CS2中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为_______杂化和_______杂化。
(5)+3价M的配合物K[M(C2O4)2(H2O)2]中,配体是______,与C2O互为等电子体的分子是(填化学式)_______。
正确答案
(1)
(2)B
(3)B
(4)①分子 ②
(5)

解析
解析已在路上飞奔,马上就到!
知识点
考生从两道物理题、两道化学题中各任选一题作答。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
其中第28、29题为物理题,第30、31题为化学题。考生从两道物理、两道化学题中各任选一题作答。
30.(选考——物质结构与性质)
X、Y、Z、Q为短周期非金属元素, R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为( ) 。
(2) X、Y、Z三种元素第一电离能从大到小顺序为( )。
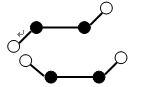
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是( )
A. 仅1个σ键
B. 1个σ键和2个π键
C. 1个σ键和1个π键
D. 仅2个σ键
②该分子中Y原子的杂化方式是( )
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式
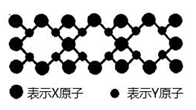
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 ( )
A. 该晶体属于分子晶体
B. 此晶体的硬度比金刚石还大
C. 晶体的化学式是X3Y4
D. 晶体熔化时共价键被破坏,没有克服范德华力和氢键
31.(选考——有机化学基础)
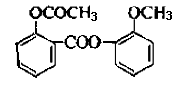
醋柳酯是一种镇咳祛痰药。用于上呼吸道感染、感冒咳嗽、急慢性支气管炎症等的治疗,其结构简式如右。回答下列问题:
(1)醋柳酯的分子式为 ( )。
(2)关于醋柳酯说法正确的是为( )
A.是高分子化合物
B.可与氢气发生加成反应
C.不能发生银镜反应
D.能发生水解反应且只生成2种有机物
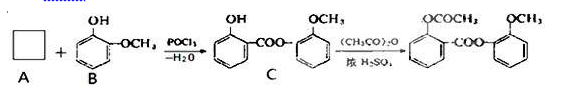
(3)醋柳酯可由下图所示路线合成
①中间产品C中混有反应物A和B,检验C中含有A的反应可以是(用化学反应方程式表示)
②写出C和足量NaOH溶液反应的化学方程式( )。
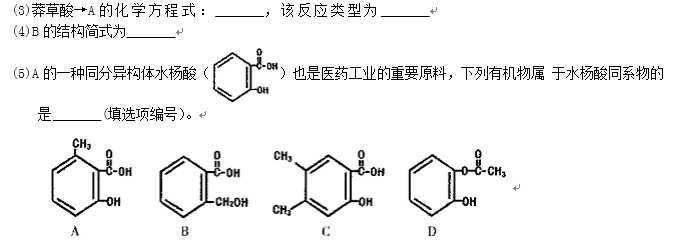
③A的同分异构体很多,写出属于酯类,且能与FeCl3反应显紫色的同分异构体的结构简式是( )。
30. (选考——物质结构与性质)
X、Y、Z、Q为短周期非金属元素, R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为 。
(2) X、Y、Z三种元素第一电离能从大到小顺序为 。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):

正确答案
第29、30题为物理题,第31、32题为化学题,考生从两道物理、化学题中任选一题作答。
31.[化学——物质结构与性质]
碳的多样性体现了物质世界的多样性。
(1)2010年诺贝尔物理学奖所指向的是碳的又一张奇妙脸孔:人类已知的最薄材料——石墨烯。
下列说法中,正确的是( )(填标号)。
A.固态时,碳的各种单质的晶体类型相同 B.石墨烯含有非极性键
C.从石墨剥离得石墨烯需要破坏化学键 D.石墨烯具有导电性
(2)碳纳米管的结构类似于石墨晶体或石墨烯,每个碳原子通过 杂化与周围碳原子成键,12g碳纳米管含σ键数为( ) 。
(3)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜等或合金,含碳源可以是乙炔、苯、乙醇等中的一种或任意组合。
①乙醇和二甲醚(H3C—O—CH3)是同分异构体,但乙醇的沸点比二甲醚高,主要原因是( ) 。
②铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是( )。
(4)CO与N2相似,分子中都存在一个共价叁键,其中含 个π键。上表为CO和N2的有关信息。根据表中数据,说明CO比N2活泼的原因是 ( ) 。
32.【化学一选有机化学基础】化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成:
(1)反应①属于( )(填反应类型)。
(2)化合物Ⅰ的分子式为( ),Ⅴ中含有的含氧官能团的名称为( )。
(3)合成化合物Ⅱ的方法为:( )
合成肉桂酸的反应式中,反应物的物质的量之比为1︰1,生成物A呈酸性,写出A的一种同分异构体的结构简式( )。
(4)化合物Ⅰ和Ⅱ反应还可以得到一种酯,写出该反应的化学方程式( )。
(5)下列关于化合物Ⅴ的说法正确的是( )(双选,填字母)。
A.分子中有三个苯环 B.能发生水解反应
C.使酸性KMnO4溶液褪色 D.与FeCl3发生显色反应
(6)写出肉桂酸的一种同分异构体,满足①分子中含有苯环,②羧基与苯环直接相连( )。
31.[化学——物质结构与性质]
碳的多样性体现了物质世界的多样性。

下列说法中,正确的是 (填标号)。
正确答案
第29、30题为物理题,第31、32题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
31.〔化学选考1:物质结构与性质〕
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为( ) 。
(2)N、P、As原子的第一电离能由大到小的顺序为( ) 。
(3)NH3的沸点比PH3高,原因是( );PO43-离子的立体构型为( ) 。
(4)PH3分子中P原子采用( )杂化。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因 ( )。
(6) CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 ( ) 。
32.〔化学选考2:有机化学基础〕
有机物H是用于合成药物的中间体,G为合成涤纶。请根据下列转化关系回答有关问题:
已知以下信息:
①B能与碳酸氢钠溶液反应产生二氧化碳,其苯环上一氯代物只有2种
②G为C和F一定条件下1:1反应生成的高分子化合物

(-R1、-R2表示氢原子或烃基)
(1)A的化学名称为( );C中含氧官能团名称为( ) 。
(2)H的结构简式为( );A→D的反应类型为( )。
(3)写出C和F反应生成高分子化合物的化学方程式( )。
(4)同时符合下列条件的B的同分异构体共有( ) 种(不考虑立体异构);
①能发生银镜反应 ②含有苯环结构 ③能在碱性条件下水解
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
第29、30题为物理题,第31、32题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
31.[化学——物质结构与性质]
由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态Cu+的核外电子排布式为___________。高温下CuO能转化为Cu2O,试从原子结构角度解释其原因:_______________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于___________晶体。
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过
反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3而制得。
①与上述化学方程式有关的叙述不平碜的是——(填标号)。
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1 mol(HB=NH)3分子中有_________mol
(4)在硼酸盐中,阴离子有链状、立体状等多种结构形式。图(a)是一种长链结构的硼酸根,则该硼酸根离子的化学符号为_________。图(b)是硼砂晶体中阴离子的立体状结构,
其中硼原子采取的杂化轨道类型有__________________。
32.[化学一有机化学基础]
甲苯是一种重要的化工原料。以甲苯为原料通过以下转化可得多种化工产品。
(1)写出指定物质的结构简式:A______________,M______________。
(2)C中苯环上的侧链所含官能团的名称是_______________________。
(3)E→F的反应类型是______________。
(4)关于B的说法正确的是__________(填标号)。
a.能发生银镜反应 b.遇FeCl3溶液发生显色反应
c.能发生消去反应 d.能与H2发生加成反应
(5)写出D→E反应的化学方程式:_______________________。
(6)写出符合下列条件的A的同分异构体的结构简式:__________________。
a.苯环上一氯代物只有3种
b.不能与新制氢氧化铜悬浊液反应

甲苯是一种重要的化工原料。以甲苯为原料通过以下转化可得多种化工产品。

(2)C中苯环上的侧链所含官能团的名称是_______________________。
(3)E→F的反应类型是______________。
(4)关于B的说法正确的是__________(填标号)。
a.能发生银镜反应 b.遇FeCl3溶液发生显色反应
c.能发生消去反应 d.能与H2发生加成反应
(5)写出D→E反应的化学方程式:_______________________。
(6)写出符合下列条件的A的同分异构体的结构简式:__________________。
a.苯环上一氯代物只有3种
b.不能与新制氢氧化铜悬浊液反应
正确答案
第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
30.[化学—物质结构与性质](13分)
卟啉类化合物是生物体中色素结构的常见基本单元,其结构可用右图表示
试分析该化合物中,回答下列问题
(1)氮元素基态原子的核外电子中,未成对电子数与成对电子数之比为( ) 。(2)卟啉环(不考虑取代基-R)的主要组成元素,电负性由大到小的顺序为_________。卟啉环内C原子的杂化轨道类型为___________。
(3)化合物(CN)2的结构和性质与卤素单质相似,因此称为拟卤素。已知CN-与N2具有相同的结构和成键情况。判断(CN)2分子中σ键与π键的个数比为 ______。
(4)第四周期元素M的离子可嵌入上述卟啉环中与中心四个N原子成键。
①M原子核外的未成对电子数为4个,则M原子基态的价电子排布式为___________。
②M与碳组成的某种物质的M3C,该物质在常温下能够导电,其原因是______________________________________________。
③M元素的某种化合物的熔点为282℃,沸点315℃,易溶于有机溶剂,易水解,水解最终产物的结构如下图所示,则此化合物属于________晶体,其水解产物中M的化合价为________,M的配位数为________。
31.[化学—有机化学基础]
香豆素是重要的香料、医药中间体。某研究小组设计的合成香豆素路线如下:
提示:
(1)上述合成路线中,反应⑤的反应类型是( )。
(2)H分子中含氧官能团的名称是( ),D的核磁共振氢谱图中的吸收峰有( )个。
(3)B与Cu(OH)2悬浊液反应的化学方程式为( ) 。
(4)已知芳香族化合物I是G的同分异构体,且I中苯环上只有一个取代基。则I的结构简式可能为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
30.【化学——物质结构与性质】
(1)下列分子中,属于平面型构型的有________。
A.CCl4 B.PH3 C.BBr3 D.COCl2
(2)H2O分子间因存在“氢键”的作用而彼此结合形成(H2O)n。在该分子形成的晶体中每个H2O分子被4个H2O分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图所示,试填空。
①含1molH2O的该晶体中有_____个“氢键”。
②请说明H2O比H2S的沸点高的原因___________________。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子的价电子排布式为________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是_______;
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为________。
31.【化学——有机化学基础】A、B、C、D、E均为有机物,它们具有下图的转化关系:
已知:C能与NaHCO3发生反应,C、D相对分子质量相等,E能发生银镜反应,相对分子质量为74。
请回答下列问题:
(1)写出C的名称:( ),E中含有的官能团名称( )、( );
写出有机物B可能发生的两种反应类型:( );
(2)写出反应②的化学方程式:( );
(3)A的结构简式为( );
(4)写出两种同时符合下列条件的B的同分异构体的结构简式:( ) 、( )。
①苯环上有二个间位取代基; ②属于芳香酸酯; ③能与FeCl3显色
30.【化学——物质结构与性质】
(1)下列分子中,属于平面型构型的有________。

已知:C能与NaHCO3发生反应,C、D相对分子质量相等,E能发生银镜反应,相对分子质量为74。
请回答下列问题:
(1)写出C的名称: ,E中含有的官能团名称 、 ;
写出有机物B可能发生的两种反应类型: ;
(2)写出反应②的化学方程式: ;
(3)A的结构简式为 ;
(4)写出两种同时符合下列条件的B的同分异构体的结构简式: 、 。
①苯环上有二个间位取代基; ②属于芳香酸酯; ③能与FeCl3显色
正确答案
正确答案
第29.30题为物理题,第31.32为化学题,考生从两道物理题.两道化学题中各任选一题作答。
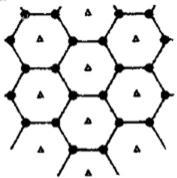
31.[选考:物质结构与性质]原子序数依次增大的四种主族元素A.B.C.D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。
请回答下列问题:
(1)这四种元素中电负性最大的是( )(填元素符号).第一电离能最小的是
(填元素符号);
(2)C所在的主族元素气态氢化物中,沸点最低的是( ) (填化学式);
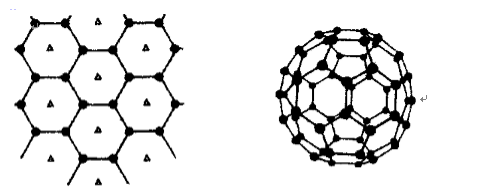
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄.最坚硬.传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原
子的杂化类型为 ( );
(4)D的水合醋酸盐晶体局部结构如图,该晶体中含有的化学键是( ) (填选项序号);
①极性键 ② 非极性键
③ 配位键 ④ 金属键
(5)某学生所做的有关D元素的实验流程如下图:
请书写第⑤反应的离子方程式:( ) 。
32.[选考:有机化学基础] PET是产量最大的合成纤维,它的化学式是
(1)PET的名称是 ( ) 。
(2)PET在酸溶液中水解生成两种烃的含氧衍生物PTA和EG(PTA.分子量大于EG),PTA的结构简式是( ) ;PTA有多种同分异构体,含三个官能团且官能团均处间位的芳香族同分异构体共有 种,其中一种的结构简式是 ( ) 。
(3)PET的水解产物EG是重要的有机化工原料。EG和有机物甲.乙.丙间存在如下的转化关系(无机反应物.生成物均已略去):
甲乙丙分子内均只含一种官能团。乙+EG→丙反应类型是( ) ;甲乙丙中的一种可以发生银镜反应,写出它与足量银氨溶液反应的化学方程式:( )。
31.[选考:物质结构与性质]原子序数依次增大的四种主族元素A.B.C.D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。
请回答下列问题:
(1)这四种元素中电负性最大的是 (填元素符号).第一电离能最小的是
(填元素符号);
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式);
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄.最坚硬.传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原
子的杂化类型为 ;
(4)D的水合醋酸盐晶体局部结构如图,该晶体中含有的化学键是 (填选项序号);
① 极性键 ② 非极性键
③ 配位键 ④ 金属键
(5)某学生所做的有关D元素的实验流程如下图:
请书写第⑤反应的离子方程式: 。
(1)PET的名称是 。
(2)PET在酸溶液中水解生成两种烃的含氧衍生物PTA和EG(PTA.分子量大于EG),PTA的结构简式是 ;PTA有多种同分异构体,含三个官能团且官能团均处间位的芳香族同分异构体共有 种,其中一种的结构简式是 。
(3)PET的水解产物EG是重要的有机化工原料。EG和有机物甲.乙.丙间存在如下的转化关系(无机反应物.生成物均已略去):

甲乙丙分子内均只含一种官能团。乙+EG→丙反应类型是 ;甲乙丙中的一种可以发生银镜反应,写出它与足量银氨溶液反应的化学方程式:
。
正确答案
31.其中第29.30题为物理题,第31.32题为化学题,考生 从两道物理题.两道化学题中各任选一题作答。
[化学——物质结构与性质]
不锈钢的种类很多,其中一种铁元素以外,还含有较多的Cr(铬).Ni(镍).Mo(钼),少量 的Si(硅).C(碳),微量的S(硫).P(磷)。
(1)上述元素中属于第三周期且第一电离能从大到小排列的是_______
(2)Mo(钼)处于第五周期,且与Cr(铬)元素位于同一族,则基态Mo(钼)原子的外围电 子(价电子)排布式是_______。
(3)CH4的沸点比SiH4低,原因是_______o
(4)镍元素能形成多种配合物,配离子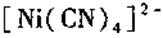
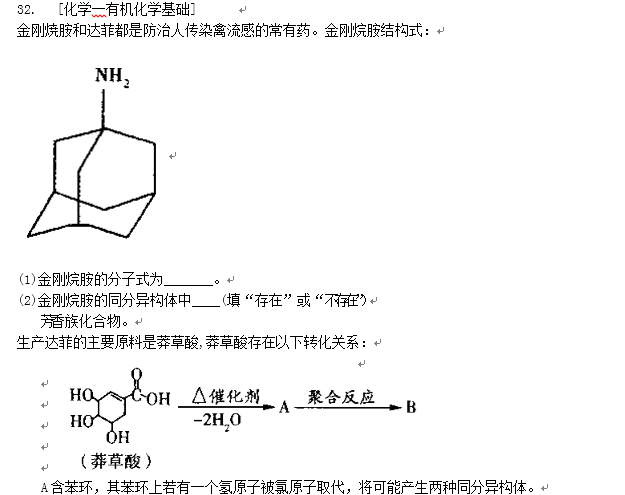
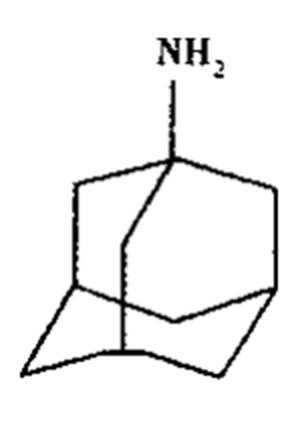
金刚焼胺和达菲都是防治人传染禽流感的常有药。金刚烷胺结构式:
(1)金刚烷胺的分子式为_______。
(2)金刚烷胺的同分异构体中____(填“存在”或“不存在”)
芳香族化合物。
生产达菲的主要原料是莽草酸,莽草酸存在以下转化关系:
正确答案
正确答案
扫码查看完整答案与解析