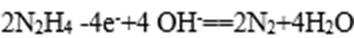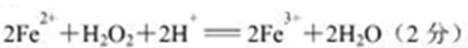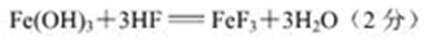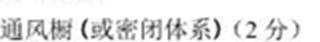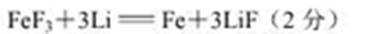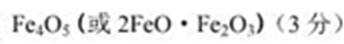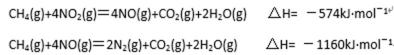- 化学方程式的书写
- 共78题
下列与处理方法对应的反应方程式不正确的是
正确答案
解析
A选项,生产中经常利用硫化物的难溶性来除去水中Cu2+、Hg2+等重金属离子;
B选项,催化法处理汽车尾气的方程式是
C选项,明矾净水的原理就是明矾中的Al3+在水中水解生成
D选项,烃类高温催化氧化生成CO2和H2O,是工业中常用的处理烃类尾气的方法。
知识点
正极材料为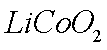
(1)橄榄石型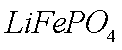
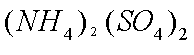
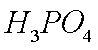
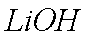
①共沉淀反应投料时,不将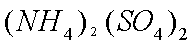
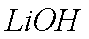
②共沉淀反应的化学方程式为 。
③高温成型前,常向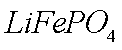
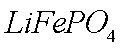
(2)废旧锂离子电池的之极材料试样(主要含有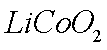
① 在上述溶解过程中,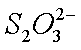
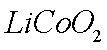
② 
正确答案
(1)①Fe2+ 在碱性条件下更易被氧化(凡合理答案均可)
②(NH4)2Fe(SO4)2+LiOH+H3PO4=LiFePO4↓+2NH4HSO4+H2O
③与空气中O2反应,防止LiFePO4中Fe2+ 被氧化(凡合理答案均可)
(2)①8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O
②CoO Co2O3、Co3O4
解析
略
知识点
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2H4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2H4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
正确答案
(1)5
(2)2NH3+NaClO==N2H4+NaCl+H2O
(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)
解析
(1)N原子的原子结构示意图为: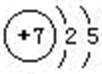
(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO==N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程式可知,②×2-①得:2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)“肼一空气燃料电池是一种碱性电池”中O2在正极反应,故负极是肼发生反应:
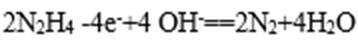
知识点
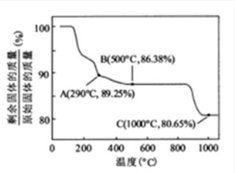
某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静
置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
正确答案
(1)
(2)C(2分)
(3)
(4)
(5)
(6)
解析
略
知识点
(1)元素M的离子与
(2)硫酸铝溶液与过量氨水反应的离子方程式为 。
(3)能证明



(填序号)。
a滴入酚酞溶液变红,再加入
b滴入酚酞溶液变红,再加入氯水后红色退去
c滴入酚酞溶液变红,在加入
(4)元素X、Y在周期表中位于同一主族,化合物

①非金属X Y(填:“<”或“<”)
②
(5)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)
正确答案
见解析。
解析
(1)写出M原子的结构示意图:
(2)Al3++3NH3H2O===Al(OH)3↓+3NH4+
(3)选C;C能证明既有反应物又有生成物。
酚酞检验OH-;A中H2SO4消耗的是OH-;B中加入氯水后红色褪去,可能是氯水直接和OH-反应。C中加入BaCl2后产生白色BaSO3沉淀,可见原体系中含有SO32-
(4)①<;
通过砖红色的Cu2Y可判断出Y是O元素(葡萄糖与菲林试剂反应生成砖红色的氧化亚铜Cu2O沉淀)
②Cu2O+6HNO3===2Cu(NO3)2+2NO2↑+3H2O
(5)温度越高,平衡常数越小。
因为从表格数据得知,D物质的量为0,平衡一定会向正方向移动,(气体体积减小)而从题干信息得知,压强升高,在恒容绝热下那一定是因为放热导致容器温度升高,从而使得压强增大,推出正方向放热。
知识点
钡盐行业生产中









(1)酸溶后溶液中


(2)酸溶时通常控制反应温度不超过
原因是 、 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是 。
正确答案
(1)Ba(FeO2)2+8HNO3=8Ba(NO3)2+2Fe(NO3)3+4H2O
(2)防止反应速度过快 浓HNO3易挥发、易分解
(3)BaCO3、Fe3+、H+
(4)减少废渣中可溶钡盐对环境的污染
解析
略
知识点
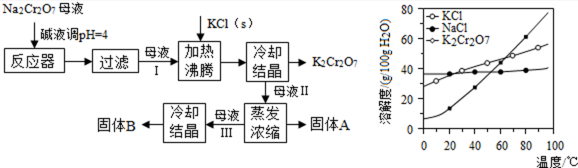
工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),工艺流程及相关物质溶解度曲线如图:
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为________, 通过冷却结晶析出大量K2Cr2O7的原因是________。
(2)向Na2Cr2O7母液中加碱液调pH的目的是________。
(3)固体A主要为________(填化学式),固体B主要为________(填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液________(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低。
正确答案
(1)Na2Cr2O7+2KCl═K2Cr2O7+2NaCl;低温下K2Cr2O7的溶解度远小于其它组分,随温度的降低,K2Cr2O7的溶解度明显减小;(合理即得分)
(2)除去Fe3+;
(3)NaCl;K2Cr2O7;
(4)Ⅱ
解析
略。
知识点
工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)
c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g)
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
则甲烷直接将NO2还原为N2的热化学方程式 为 。
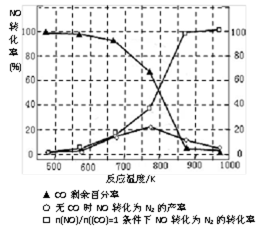
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如右图。据图分析,若不使用CO,温度超过775K发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在_______左右。
正确答案
(1)(2分)1 (2)(2分)<(写成“小于”扣1分)
(3)(4分)负极 (2分) 2NH3 — 6e- + 6OH- = N2 +6H2O (2分。化学式1分、配平1分)
(4)(3分)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-867kJ/mol (方程式2分,
△H数值1分)
(5)(5分)该反应是放热反应(1分),当在775K反应达到平衡后继续升高温度(1分),平衡向逆(左)方向移动,NO转化率降低(1分) 870K(2分。写860-875K之间任意数值均给分)
解析
略
知识点
减缓温室气体排放是2009年哥本哈根气候变化会议的议题。下列反应不产生温室气体的是
正确答案
解析
本题考查反应中产生的温室气体。A项,制玻璃的反应为:Na2CO3+SiO2 
知识点
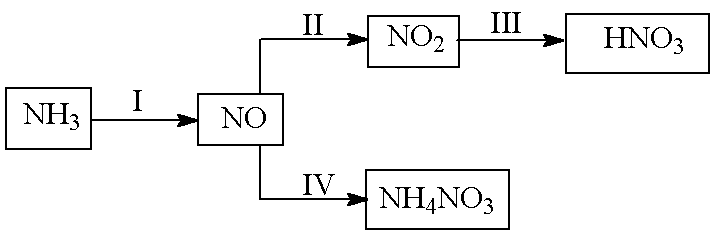
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是________________________。
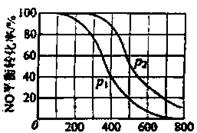
(2)II中,2NO(g) +O2(g) 
①比较p1.p2的大小关系_____________。
②随温度升高,该反应平衡常数变化的趋势是_______________。
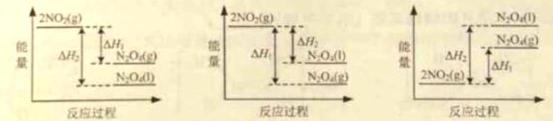
(3)III中,将NO2(g)转化成N2O4(l),再制备浓硝酸。
①已知:2NO2(g) 
2NO2(g) 
②N2O4与O2.H2O化合的化学方程式_________________________________________。
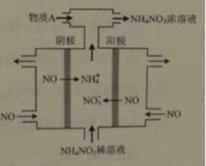
(4)IV中,电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:_____________________________________________________________。
正确答案
答案:(1)4NH3+5O2 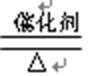
(2)①p2> p1 ②变小
(3)①A ②2N2O4+O2+2H2O=4HNO3
(4)NH3 根据电子守恒,阳极得到的NO3—的量大于阴极得到的NH4+的量,所以需充入NH3(或从阴阳极电极反应式说明也可)
解析
略
知识点
扫码查看完整答案与解析