- 化学方程式的书写
- 共78题
下列与处理方法对应的反应方程式不正确的是
正确答案
解析
A选项,生产中经常利用硫化物的难溶性来除去水中Cu2+、Hg2+等重金属离子;
B选项,催化法处理汽车尾气的方程式是
C选项,明矾净水的原理就是明矾中的Al3+在水中水解生成
D选项,烃类高温催化氧化生成CO2和H2O,是工业中常用的处理烃类尾气的方法。
知识点
正极材料为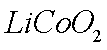
(1)橄榄石型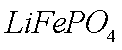
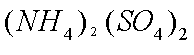
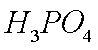
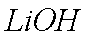
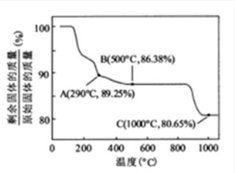
①共沉淀反应投料时,不将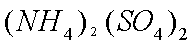
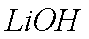
②共沉淀反应的化学方程式为 。
③高温成型前,常向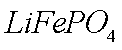
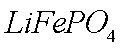
(2)废旧锂离子电池的之极材料试样(主要含有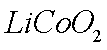
① 在上述溶解过程中,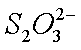
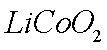
② 
正确答案
(1)①Fe2+ 在碱性条件下更易被氧化(凡合理答案均可)
②(NH4)2Fe(SO4)2+LiOH+H3PO4=LiFePO4↓+2NH4HSO4+H2O
③与空气中O2反应,防止LiFePO4中Fe2+ 被氧化(凡合理答案均可)
(2)①8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O
②CoO Co2O3、Co3O4
解析
略
知识点
(1)元素M的离子与
(2)硫酸铝溶液与过量氨水反应的离子方程式为 。
(3)能证明



(填序号)。
a滴入酚酞溶液变红,再加入
b滴入酚酞溶液变红,再加入氯水后红色退去
c滴入酚酞溶液变红,在加入
(4)元素X、Y在周期表中位于同一主族,化合物

①非金属X Y(填:“<”或“<”)
②
(5)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)
正确答案
见解析。
解析
(1)写出M原子的结构示意图:
(2)Al3++3NH3H2O===Al(OH)3↓+3NH4+
(3)选C;C能证明既有反应物又有生成物。
酚酞检验OH-;A中H2SO4消耗的是OH-;B中加入氯水后红色褪去,可能是氯水直接和OH-反应。C中加入BaCl2后产生白色BaSO3沉淀,可见原体系中含有SO32-
(4)①<;
通过砖红色的Cu2Y可判断出Y是O元素(葡萄糖与菲林试剂反应生成砖红色的氧化亚铜Cu2O沉淀)
②Cu2O+6HNO3===2Cu(NO3)2+2NO2↑+3H2O
(5)温度越高,平衡常数越小。
因为从表格数据得知,D物质的量为0,平衡一定会向正方向移动,(气体体积减小)而从题干信息得知,压强升高,在恒容绝热下那一定是因为放热导致容器温度升高,从而使得压强增大,推出正方向放热。
知识点
钡盐行业生产中









(1)酸溶后溶液中


(2)酸溶时通常控制反应温度不超过
原因是 、 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是 。
正确答案
(1)Ba(FeO2)2+8HNO3=8Ba(NO3)2+2Fe(NO3)3+4H2O
(2)防止反应速度过快 浓HNO3易挥发、易分解
(3)BaCO3、Fe3+、H+
(4)减少废渣中可溶钡盐对环境的污染
解析
略
知识点
减缓温室气体排放是2009年哥本哈根气候变化会议的议题。下列反应不产生温室气体的是
正确答案
解析
本题考查反应中产生的温室气体。A项,制玻璃的反应为:Na2CO3+SiO2 
知识点
扫码查看完整答案与解析