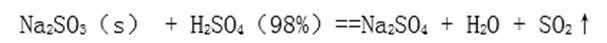- 化学方程式的书写
- 共78题
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是()
正确答案
解析
略
知识点
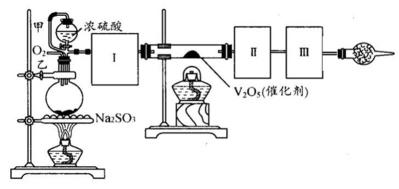
26.用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是445.8℃。已知发生装置中所涉及反应的化学方程式为:
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。Ⅰ、Ⅱ、Ⅲ处连接的装置分别是( )、( )、( )。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 ( ) 。
(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式( )。
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为( )%(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是( ) 。
正确答案
(1) B A E或B A C
(2)先加热催化剂再滴入浓硫酸
(3)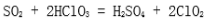
(4)
(5)防止空气中的CO2及水蒸气干扰,造成误差
解析
解析已在路上飞奔,马上就到!
知识点
13.某溶液中可能含有
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.锌广泛用于轻工、建筑、汽车、船舶等行业。但随着锌资源的不断开发和利用,锌矿资源越来越少,因此研究利用锌二次资源对缓解锌资源枯竭进程具有重要意义。以锌渣(主要成分是锌及其氧化物,含铁、铜的氧化物杂质)为原料生产皓矾(
回答下列问题:
(1)酸浸时锌渣中的锌发生的主要反应方程式为________________________________。
(2)漂白粉中的主要成分有___________________(填化学式),加入漂白粉的目的是将滤液中的



(3)加入锌粉置换可除去溶液中的少量
(4)向皓矾溶液中加入


正确答案
(1)
(2)
(3)
(4)
解析
解析已在路上飞奔,马上就到!
知识点
12.已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析