- 化学方程式的书写
- 共78题
29.某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H5OH ②有关有机物的沸点:
请回答:
⑴ 浓硫酸的作用是( ▲ );仪器A的名称是( ▲ );若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式( ▲ )

⑶ 待实验结束后,观察发现装置B中溶液变成了棕黑色,试用化学方程式解释其原因:( ▲ ) 。
⑷ 从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇;然后在混合液中加入沸石,再加热进行蒸馏,收集( ▲ )左右的馏分,以得较纯净的乙酸乙酯。
正确答案
⑴ 制乙酸、催化剂、吸水剂;分液漏斗 化学方程式略
⑵ 防止倒吸; 2 CH3COOH + CO32- =2CH3COO-+ CO2 +H2O
⑶ C2H5OH+2H2SO4→2C+2SO2+5H2O;
⑷ 77.1℃
解析
解析已在路上飞奔,马上就到!
知识点
24.某学习小组利用某工业废弃固体(主要成分为Cu2S和_Fe2O3)来研究相关物质的制备。设计方案如图所示:
(1)废弃固体在空气中灼烧,发生反应的化学方程式为_______________。
(2)溶液C通过_________、_________、过滤等操作得到Fe2(SO4)3晶体。
(3)常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液B后,
随即生成硫酸铜。这一过程中反应的化学方程式依次为:
(4)操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中加入试剂Y以调节pH使得铁元素沉淀完全(含铁元素的离子浓度小于10-5mol·L-1)。试剂Y可以是____________,调节溶液的pH不小于____________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 ( ) 。
②从反应后的混合物中分离出产品的实验方法是( )(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
②根据①的结论:取氨基甲酸铵样品3.95 g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97 g。则样品中氨基甲酸铵的物质的量分数为_______________。[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(BaCO3)=197]
正确答案
(1)浓氨水与氢氧化钠固体等合理答案
(2)①降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);
通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率)
②过滤 c
(3)①
②0.800或80.0%(有效数字没有考虑不扣分)
解析
解析已在路上飞奔,马上就到!
知识点
7. 下列反应式的表达中,正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)写出圆底烧瓶中反应的化学方程式( ) 。
(2)A中m管的作用是( );装置F的作用是( ) 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是( ) ,C中应盛放的试剂是( ) 。
(4)E中若装有FeCl2溶液,反应的离子方程式为( );E中若装有淀粉碘化钾溶液,能观察到的实验现象是 ( ) 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ( );实验c的目的是 ( ) 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 ( )。
29.二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)写出圆底烧瓶中反应的化学方程式 。
(2)A中m管的作用是 ;装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 ,C中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
正确答案
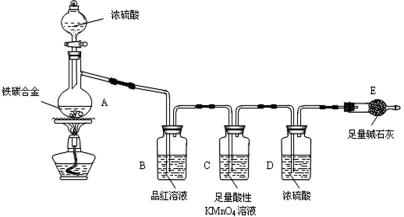
28.现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
I 测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后__________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为__________________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是___________________________________________________________。
(5)乙同学按照甲同学认为改进实验,改进方法是______________但测得合金中铁的质量分数却偏高。你认为其中可能的原因是_________________。
Ⅱ 探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
(1)若某种固体物质受热发生了分解,下列说法正确的是( )
A.充分加热后一定有固体残留
B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化
D.一定生成了新的物质E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到
(3)如果加热温度为
(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取( )的措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是( )(填“甲”或“乙”),请说明另一方案不合理的原因( )。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(5)写出Na2SO3固体加热到600℃以上分解的化学方程式( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下:Ksp(CuS) ( ) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的( )(填序号)作为试剂甲是最合适的。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在( )范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方
程式( )。
(5)298K时,残留在溶液中的c(Fe3+)在( )。以下。
(6)乙的溶液可直接用作氮肥,则乙的化学式是( ) 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.某同学想通过利用下图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物
实验后测得反应前C管的质量为m1 g,反应后C管的质量为m 2 g,反应后装置D质量增加了n g。请分析:
Ⅰ.装置B的作用 ( )。
装置D的作用 ( ) 。
Ⅱ.如何检验反应中是否有O2生成 ( )。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: ( ) 。
(1)若按假设2进行,反应方程式为 ( ) 。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:
得出结论:产物是Na2SO4。
该方案是否合理( )(填“是”或“否”),理由是( )。
(3)若假设1成立,某同学以反应前后C管的质量差( m 2 - m 1 )g为依据推断生成Na2SO3的质量为( m 2 - m 1 )×126/64 g。老师提示推算不合理,请你分析其中的缘由: ( ).
(4)若假设2成立,则参加反应的Na2O2 物质的量为( )(列计算式)摩尔。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10、能正确表示下列化学反应的离子方程式或化学方程式的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析