- 人工合成有机化合物的应用
- 共7题
2.下列物质不可用作食品添加剂的是
正确答案
知识点
4.下列叙述错误的是
正确答案
知识点
4.下列有关离子方程式书写或离子共存说法正确的是
正确答案
解析
A:Na2CO3溶液水解显碱性,CO32-会和NH4+、Al3+发生双水解而不能大量共存,错
B:常温下,由
C:锅炉的成分是CaSO4,加入纯碱,是利用了溶度积的概念及沉淀的转化,其中KSP CaSO4>KSP CaCO3,据此离子反应方程式,有溶度积大的可以向小的转化,对
D:此化学方程式正确的离子方程式为:3Ba2++3SO42-+2Al3++6OH-=3BaSO4↓+2Al(OH)3↓
考查方向
解题思路
Na2CO3溶液水解显碱性,CO32-会和NH4+、Al3+发生双水解而不能大量共存,常温下,
易错点
规范书写化学方程式,对Kw的理解并进行运用,盐类水解的概念理解错误
知识点
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
请回答下列问题:
11.加入ZnO调节pH=a的目的是____________________,a的范围是 。
12.由不溶物E生成溶液D的化学方程式为______________________________。
13.滤液A中加入H2O2反应的离子方程式为 。
14.由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
15.下列试剂可作为Y试剂的是______。A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是___________________。
正确答案
使溶液中的Fe3+完全沉淀,Zn2+不被沉淀
3.0≤a<5.9
解析
废旧黄铜中含有Cu、Fe、Zn加入过量稀硫酸后铜不溶解,得到滤液A中有Fe2+ 、Zn2+加入双氧水将其中的Fe2+氧化成Fe3+,加入氧化锌,调节溶液PH在3.0~5.9之间,便可将Fe3+除尽,而不影响Zn2+
考查方向
化工流程 化学知识在生产中的应用
解题思路
认真审题,充分把握信息对于陌生的流程不要急,在边看边解中加深理解。
易错点
结合信息有关化学方程式及离子方程式的书写
正确答案
2Cu+O2+2H2SO4 =2CuSO4+2H2O
解析
不溶物E是Cu,加入硫酸同时通入氧气可将其溶解:2Cu+O2+2H2SO4 =2CuSO4+2H2O
考查方向
解题思路
认真审题,充分把握信息对于陌生的流程不要急,在边看边解中加深理解。
易错点
结合信息有关化学方程式及离子方程式的书写
正确答案
2Fe2++H2O2+2H+=2Fe3+ +2H2O
解析
滤液A中含有Fe2+,加入双氧水将其氧化:2Fe2++H2O2+2H+=2Fe3+ +2H2O
考查方向
解题思路
认真审题,充分把握信息对于陌生的流程不要急,在边看边解中加深理解。
易错点
结合信息有关化学方程式及离子方程式的书写
正确答案
蒸发浓缩、冷却结晶、过滤
解析
将CuSO4溶液蒸发浓缩、冷却结晶、过滤便可得到CuSO4晶体。
考查方向
解题思路
认真审题,充分把握信息对于陌生的流程不要急,在边看边解中加深理解。
易错点
结合信息有关化学方程式及离子方程式的书写
正确答案
B 先产生白色沉淀后沉淀溶解
解析
在滤液A中加入氢氧化钠,调节PH到11,让Fe2+形成沉淀,而Zn2+先形成Zn(OH)2沉淀,后溶解达到分离的目的。
考查方向
解题思路
认真审题,充分把握信息对于陌生的流程不要急,在边看边解中加深理解。
易错点
结合信息有关化学方程式及离子方程式的书写
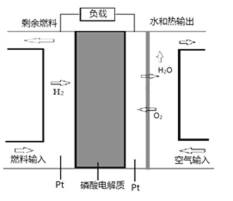
7. 某种PAFC是以磷酸为电解质、Pt为电极的燃料电池(如图所示),具有电解质稳定、构造简单等特点。浓磷酸的凝固点是42°C, PAFC的工作温度通常在150-220°C。以下说法错误的是( )
正确答案
解析
A.通入氧气的一极为正极,原电池工作时,阳离子向正极移动,故A正确;
B.浓磷酸为电解质溶液,不可能生成OH-,电极方程式为O2+4e-+4H+=2H2O,故B错误;
C.PAFC的工作温度通常在150-220°C,常温下不反应,故C正确;
D.负极发生氧化反应,甲醇被氧化生成二氧化碳气体,电极方程式为CH3OH+H2O-6e-═CO2↑+6H+,故D正确.
本题正确答案是B
考查方向
解题思路
A.原电池工作时,阳离子向正极移动;
B.浓磷酸为电解质溶液,不可能生成OH-;
C.PAFC的工作温度通常在150-220°C,常温下不反应;
D.负极发生氧化反应,甲醇被氧化生成二氧化碳气体
易错点
原电池原理、正负极的判断、电极反应式的书写;
知识点
13.根据下列实验操作及现象,能得出相应结论的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列叙述不正确是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析