- 有机物分子中的官能团及其结构
- 共96题
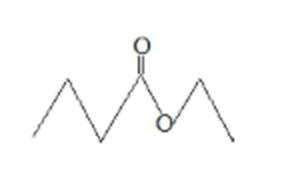
2.茅台酒中存在少量具有凤梨香味的物质X,其结构如右下图所示。下列说法正确的是( )
正确答案
解析
A.该物质中含有酯基,具有酯的性质,根据相似相溶原理知,该物质易溶于有机溶剂乙醇,故A错误;
B.该物质为丁酸乙酯,一定条件下能发生水解反应生成丁酸和乙醇,所以酒中的少量丁酸能抑制X水解,故B正确;
C.分子式为C4H8O2且官能团与X相同的物质中含有酯基,可能是甲酸正丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯飞,符合条件的同分异构体有4种,故C错误;
D.该物质分子式为C6H12O2,根据原子守恒判断X完全燃烧生成二氧化碳和水的物质的量之比,X完全燃烧后生成CO2和H20的物质的量比为1:1,故D错误;
考查方向
解题思路
A.该物质中含有酯基,具有酯的性质,该物质易溶于有机溶剂;
B.该物质为丁酸乙酯,一定条件下能发生水解反应生成丁酸和乙醇;
C.分子式为C4H8O2且官能团与X相同的物质中含有酯基,可能是甲酸正丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯;
D.该物质分子式为C6H12O2,根据原子守恒判断X完全燃烧生成二氧化碳和水的物质的量之比.
易错点
有机物性质的判断
知识点
甲醇是一种重要的可再生能源。
25.还可通过下列反应制甲醇:CO(g)+2H2(g) 
26.在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______(填字母)。A.H2的消耗速率等于CH3OH的生成速率的2倍B.H2的体积分数不再改变C.体系中H2的转化率和CO的转化率相等D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入
27.以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池负极反应式_________
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
28.已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a kJ•mol-1
CO(g)+2H2(g)=CH3OH(g) ΔH =b kJ•mol-1
试写出由CH4和O2制取甲醇的热化学方程式 _____________________
正确答案
0.15mol·L-1·min-1
解析
(2)由反应方程式:CO(g)+2H2(g) 
υ(CO)=,υ(H2)=
考查方向
解题思路
本题涉及到的内容是考试中的热点问题,复习过程中一定要高度重视。解这类综合题时,一般是按顺序逐步解决,根据题目考查的内容找到相对应的解决方法,如求反应速率时,想到化学反应速率的计算公式v=C/t 。现在数形结合的题目在增加,这需要学生有较好的对图形解读能力,排除干扰找到解题的关键所在。如在判断P大小是,先定好在相同温度下,分析出转化率的大小,由转化率的大小判断出压强的大小,千万不要在杂乱的数据中迷失了自己。
易错点
化学平衡常数的运用及平衡建立的标志、及对图形数据的解读能力
正确答案
①BD ②< ③4L
解析
①反应的任意时刻υ(H2)正:υ(CH3OH)正=2:1,A错误。H2的体积分数不再改变,反应达平衡状态,B正确。由于初始投入的H2 、CO二者的量之比为2:1,而反应过程中消耗的H2 与CO也是按2:1进行,所以二者在任意时间转化率均相等,C错误。,该反应生成物与反应物均为气体,所以m是定值,但反应进行过程中,n值会不断变化,当M不变反应达到平衡状态,D正确。
②在温度相同的情况下,本反应的压强越大CO的转化率越大,故PA<PB 。③
考查方向
解题思路
本题涉及到的内容是考试中的热点问题,复习过程中一定要高度重视。解这类综合题时,一般是按顺序逐步解决,根据题目考查的内容找到相对应的解决方法,如求反应速率时,想到化学反应速率的计算公式v=C/t 。现在数形结合的题目在增加,这需要学生有较好的对图形解读能力,排除干扰找到解题的关键所在。如在判断P大小是,先定好在相同温度下,分析出转化率的大小,由转化率的大小判断出压强的大小,千万不要在杂乱的数据中迷失了自己。
易错点
化学平衡常数的运用及平衡建立的标志、及对图形数据的解读能力
正确答案
①CH3OH+8OH- -6e- =CO32-+6H2O
②c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
解析
①燃料电池的负极通入的为甲醇,发生氧化反应,原本应当形成CO2但是溶液是以KOH为电解质,故最终反应变为CO32-,反应式为:CH3OH+8OH- -6e- =CO32-+6H2O
②由信息设反应方程式为:0.8KOH+0.5CO2=xK2CO3+yKHCO3+zH2O,则x+y=0.5 2x+y=0.8联解求得x=0.3 y=0.2
即0.3molK2CO3 0.2molKHCO3,因此离子浓度大小关系为:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
考查方向
解题思路
本题涉及到的内容是考试中的热点问题,复习过程中一定要高度重视。解这类综合题时,一般是按顺序逐步解决,根据题目考查的内容找到相对应的解决方法,如求反应速率时,想到化学反应速率的计算公式v=C/t 。现在数形结合的题目在增加,这需要学生有较好的对图形解读能力,排除干扰找到解题的关键所在。如在判断P大小是,先定好在相同温度下,分析出转化率的大小,由转化率的大小判断出压强的大小,千万不要在杂乱的数据中迷失了自己。
易错点
化学平衡常数的运用及平衡建立的标志、及对图形数据的解读能力
正确答案
2CH4(g)+O2(g)=2CH3OH(g)ΔH=(a+2b)kJ·mol-1
解析
将① 2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a kJ·mol-1
② CO(g)+2H2(g)=CH3OH(g) ΔH=b kJ·mol-1
将①+2②得到2CH4(g)+O2(g)=2CH3OH(g)ΔH=(a+2b)kJ·mol-1
考查方向
化学反应中的能量变化、化学平衡、电化学、离子浓度大小比较等综合知识
解题思路
本题涉及到的内容是考试中的热点问题,复习过程中一定要高度重视。解这类综合题时,一般是按顺序逐步解决,根据题目考查的内容找到相对应的解决方法,如求反应速率时,想到化学反应速率的计算公式v=C/t 。现在数形结合的题目在增加,这需要学生有较好的对图形解读能力,排除干扰找到解题的关键所在。如在判断P大小是,先定好在相同温度下,分析出转化率的大小,由转化率的大小判断出压强的大小,千万不要在杂乱的数据中迷失了自己。
易错点
化学平衡常数的运用及平衡建立的标志、及对图形数据的解读能力
高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
实验流程如下:
已知K2MnO4溶液显绿色,KMnO4溶液紫红色。请回答下列问题:
20.步骤①应在 中熔化,并用铁棒用力搅拌,以防结块。
21.综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是 。
22.下列监控K2MnO4歧化完全的方法或操作可行的是 。
23.当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是 。
24.烘干时,温度控制在80℃为宜,温度不宜过高的理由是 。
25.通过用草酸滴定酸化后的KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①滴定过程溶液中发生的离子反应为 。
②称量w g KMnO4粗产品配制成100ml待测溶液,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有 、 。
③量取KMnO4待测液10.00ml,若该滴定管用蒸馏水洗净后未润洗,则测定结果将 。
④滴定终点溶液的颜色变化是 。
⑤经测定每滴定10.00ml待测液平均消耗c mol/L草酸标准液Vml,样品纯度的表达式为 (高锰酸钾摩尔质量用M表示)。
正确答案
解析
步骤①熔融固体需要在坩埚中进行,且熔融的物质和坩埚成分不反应,步骤①中含有KOH碱性物质,KOH能和SiO2反应生成硅酸钾,所以应该用铁坩埚熔融,故选D
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
解析
①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂具有酸性,且和锰酸钾、高锰酸钾都不反应,稀盐酸和二氧化锰都能被酸性高锰酸钾溶液氧化,所以不能选取,硫酸酸性太强,可以选取醋酸,故选B
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
解析
如果溶液中存在K2MnO4,通入CO2会产生沉淀,且K2MnO4溶液显绿色,KMnO4溶液紫红色,所以可以通过通入二氧化碳是否产生沉淀及溶液在滤纸上的颜色判断,故选B
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
CO2与K2CO3溶液反应生成KHCO3,结晶时会同KMnO4一起结晶析出,产品纯度降低
解析
当溶液pH值达10~11时,停止通CO2;若CO2过多,二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低,故答案为:二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低。
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
温度过高,产品受热分解
解析
如果温度过低,烘干时间过长,如果温度过高,会导致高锰酸钾分解,产率降低。
故答案为:如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
①2MnO4- + 5H2C2O4 +6H+=2Mn2+ + 10CO2↑ +8H2O
②100ml容量瓶 、 胶头滴管
③偏小
④溶液由红色变无色
⑤(cVM)/250W
解析
① 滴定过程中2MnO4-+5H2C2O4+6H+→10CO2↑+2Mn2++8H2O,注意草酸是弱酸,不能拆开;
②称量w g KMnO4粗产品配制成100ml待测溶液,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有100ml容量瓶 、 胶头滴管;
③酸式滴定管未用标准液润洗,滴定管内壁残余水分,稀释了KMnO4,使得KMnO4体积增大,由c(KMnO4)=c(H2C2O4)V(H2C2O4)/V(KMnO4)可知计算出的结果偏小;
④用草酸滴定酸化后的KMnO4溶液,滴定终点溶液的颜色变化是由紫红色(MnO4-)变为无色(Mn2+);
⑤根据c(KMnO4)=c(H2C2O4)V(H2C2O4)/V(KMnO4),因此c(KMnO4)=CV/10,因为c=n/v,n=m/M,且配制成100ml待测溶液,量取KMnO4待测液10.00ml,因此KMnO4的质量m=cVM,样品纯度的表达式为(cVM)/250W
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
5.X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数
正确答案
解析
X元素的原子形成的离子就是一个质子,故X为H,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且为短周期非金属元素,原子序数依次增大Z为N,W为O,Y原子的最外层电子数是内层电子数的2倍所以Y为C,M是地壳中含量最高的金属元素,所以M是Al.
A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X,即Al>O>N>C>H,A错误;
B.X、Z两元素分别为H、N元素,可形成氨气和N2H4,故B正确;
C.化合物YW2 (CO2)、ZW2 (NO2)都是酸性氧化物,CO2是酸性氧化物,NO2不是酸性氧化物,C错误;
D.电解时氢氧根阴离子向阳极移动,在阳极区会出现白色沉淀(Al(OH)3),故D错误。
本题正确答案是B
考查方向
解题思路
X元素的原子形成的离子就是一个质子,故X为H,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且为短周期非金属元素,原子序数依次增大Z为N,W为O,Y原子的最外层电子数是内层电子数的2倍所以Y为C,M是地壳中含量最高的金属元素,所以M是Al.
易错点
元素周期律的推断,元素的结构与性质
知识点
1.下列说法不正确的是( )
正确答案
解析
A.煤的气化是将其转化为可燃性气体的过程,属于化学变化;煤的液化是使煤与氢气作用生成液体燃料,属于化学变化;
B.油脂相对分子质量较小,不属于高分子化合物;
C.棉花属于天然植物纤维 羊毛和蚕丝属于天然动物纤维.;
D.陶瓷、玻璃和水泥都属于传统硅酸盐产品,其主要成分都含有硅酸盐。
考查方向
解题思路
A.没有新物质生成的变化是物理变化,有新物质生成的变化是化学变化;
B.相对分子质量在10000以上的有机化合物为高分子化合物;
C.棉花属于天然植物纤维 羊毛和蚕丝属于天然动物纤维.;
D.陶瓷、玻璃和水泥都属于传统硅酸盐产品。
易错点
煤的气化、煤的液化属于化学变化
知识点
扫码查看完整答案与解析