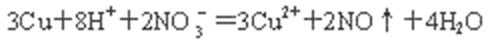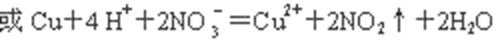- 绿色化学
- 共179题
工业上制取硝酸铵的流程图如下,请回答下列问题:
(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2催化剂△ 7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时应注意的事项及理由是:
正确答案
(1)氧化炉; 4NH3+5O2 催化剂△4NO+6H2O。
(2)铁砂网(或铁);N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂
(3)利用余热,节约能源;可使NO循环利用,全部转化成HNO3
(4)NH3还原法
(5)53
(6)①不能与碱性肥料混施 硝酸铵溶液呈酸性;
②不能剧烈撞击 硝酸铵易爆炸;③不能在雨水较多的地区使用 硝酸铵吸水性强,易流失
解析
略
知识点
下列行为中不符合“促进低碳经济”宗旨的是
正确答案
解析
略
知识点
“化学,让城市更美好”,下列叙述不能直接体现这一主旨的是
正确答案
解析
略
知识点
在“绿色化学工艺”中,理想状态是原子利用率为100%。在用CH3C
正确答案
解析
略
知识点
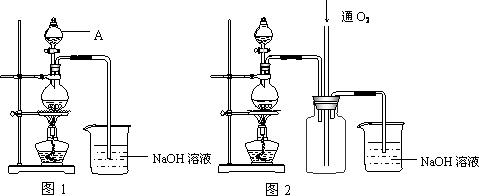
硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
(1)图1烧瓶中发生的离子反应方程式为:
(2)图2是图1的改进装置,其优点有:
① ;② 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤.蒸发.结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7.6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。a.CaO b.CuCO3 c.CaCO3 d.NH3▪H2O
以加入FeSO4为例,用离子方程式解释反应发生的原因
。
方案3 :将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5小时后,升温到60℃,持续反应1 小时后,过滤.蒸发结晶.减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.6g。
③上述三种方案中,更符合绿色化学理念的是 ,(填方案1、方案2、方案3)
理由是 . .
正确答案
(1)
(2)① 防止倒吸 ② 有害气体能被完全吸收
(3)① 坩埚 ② b
4Fe2+ + O2 + 4 H+ == 4Fe3+ + 2H2O
2Fe3+ + Cu == 2Fe2+ + Cu2+
③ 方案3 ;方案1需要灼烧,多消耗能源,方案二所得产品含有铁元素杂质,方案三几乎不产生有害气体,且所得产品纯度较高。
解析
略
知识点
扫码查看完整答案与解析