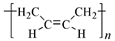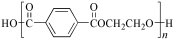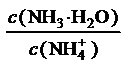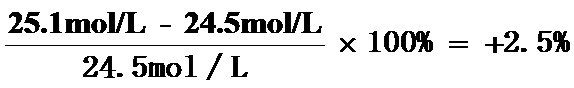- 有机化合物的异构现象
- 共52题
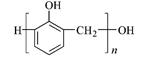
5.关于下列三种常见高分子材料的说法正确的是( )
顺丁橡胶
涤纶
酚醛树脂
正确答案
解析
A.顺丁橡胶是由丁二烯聚合而成、涤纶是对苯二甲酸和乙二醇通过缩聚反应得到的,酚醛树脂酚醛树脂是苯酚和甲醛合成的,它们都属于天然高分子材料,所以A错误;
B.顺丁橡胶的单体是CH2=CH—CH=CH2,是二烯烃,而反-2-丁烯为单烯烃,同分异构体必须是含有相同种类和数目的官能团,所以CH2=CH—CH=CH2和反-2-丁烯不是同分异构体;所以B错误;
C.涤纶的单体为对苯二甲酸和乙二醇,它们通过缩聚反应得到的涤纶,所以C正确;
D.酚醛树脂是指酚与醛在酸性或碱性催化剂存在下缩聚而成的树脂性聚合物的总称,通常指的是从苯酚或其同系物 (如甲酚、二甲酚等) 与甲醛缩合得到的树脂,所以它们的单体可以是苯酚和甲醛,所以D错误。
考查方向
考查常见高分子分类、材料结构、合成的反应类型及单体的知识。
解题思路
准确掌握有关材料的分类以及性质的基础知识该题的关键是准确判断出高分子化合物是加聚产物还是缩聚产物,然后灵活运用即可。
A.顺丁橡胶是由丁二烯聚合而成、涤纶是对苯二甲酸和乙二醇通过缩聚反应得到的,酚醛树脂酚醛树脂是苯酚和甲醛合成的,它们都属于天然高分子材料;
B.顺丁橡胶的单体是CH2=CH—CH=CH2,是二烯烃,而反-2-丁烯为单烯烃,不是同分异构体;
C.涤纶的单体为对苯二甲酸和乙二醇,它们通过缩聚反应得到的涤纶
D.酚醛树脂是指酚与醛在酸性或碱性催化剂存在下缩聚而成的树脂性聚合物的总称,通常指的是从苯酚或其同系物 (如甲酚、二甲酚等) 与甲醛缩合得到的树脂,所以它们的单体可以是苯酚和甲醛。
易错点
不能准确判断天然产生的高分子化合物和人工合成的高分子化合物。不了解酚醛树脂是苯酚和甲醛合成的。
知识点
1.轴烯是一类独特的星形环烃。三元轴烯(
正确答案
知识点
3.下列说法正确的是( )
正确答案
解析
A.分子式为C2H6O的有机化合物存在同分异构体,即乙醇或甲醚,二者属于不同的有机物,性质不同,故A错误;B.化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,故ab两种途径,放出的热量一样多,故B错误;C.氧化还原反应中存在得失电子守恒定律,即还原剂失去电子总数等于氧化剂得到电子的总数,故C正确;D.汽油中含有C和H两种元素,而水中只存在H和O两种元素,故不可能通过化学变化直接将水转变为汽油,故D错误,
故选C.
考查方向
解题思路
A.分子式为C2H6O的有机化合物存在同分异构体;B.化学反应的热效应只与反应物的初始状态和生成物的最终状态有关;C.氧化还原反应本质电子的得失,且得失电子守恒;D.水中只含有H和O两种元素,汽油中含有C和H两种元素,依据元素守恒解答即可.
易错点
本题主要考查的是有机物同分异构体的判断、化学反应的热效应、氧化还原反应等,综合性较强,难度一般.
知识点
5.A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍。下列说法正确的是( )
正确答案
解析
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A和C、B和D分别位于同主族,假设A是H元素,B的原子序数小于C,则C是Na元素,且B、D质子数之和是A、C质子数之和的2倍,则B是O元素,D是S元素,所以假设成立,E为主族的短周期元素,且原子序数最大,E是Cl元素, A.原子核外电子层数越多,原子半径越大,应为Na>S>O,故A错误; B.C为Na,在第三周期中金属性最强,最高价氧化物对应水化物的碱性在同周期中最强,故B正确. C.E分别与A、C形成的化合物分别为氯化氢、氯化钠,分别为共价化合物和离子化合物,化学键类型不同,故C错误; D.非金属性O>S,非金属性越强,对应的氢化物越稳定,故D错误;
故选B.
考查方向
解题思路
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A和C、B和D分别位于同主族,假设A是H元素,B的原子序数小于C,则C是Na元素,且B、D质子数之和是A、C质子数之和的2倍,则B是O元素,D是S元素,所以假设成立,E为主族的短周期元素,且原子序数最大,E是Cl元素,结合对应单质化合物的性质以及元素周期率知识解答该题.
易错点
本题的关键是根据原子结构特点正确推断元素的种类.
知识点
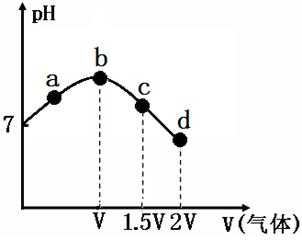
6.常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发)。下列叙述不正确的是()
正确答案
解析
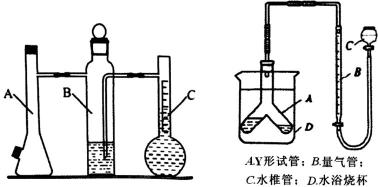
A.a点到b点是向饱和氯化钠溶液中通入氨气达到饱和,溶液中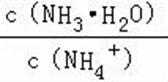
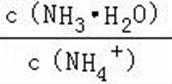
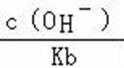
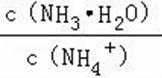
B.b到c点是一水合氨和通入的二氧化碳反应得到碳酸铵溶液,c到d点是碳酸铵和二氧化碳反应生成碳酸氢铵,在溶液中依据溶解度大小最后反应生成碳酸氢钠晶体和氯化铵溶液,由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性,故B正确;
C.c点所示溶液是碳酸铵溶液,图象分析可知溶液显碱性,离子浓度大小为:c(NH4+)>c(CO32﹣)>c(OH﹣)>c(H+),故C正确;
D.d点是氯化铵溶液和碳酸氢钠饱和溶液,溶液中存在氮物料守恒,碳元素守恒,析出碳酸氢钠,则溶液中氯离子大于溶液中钠离子,c(NH4+)+c(NH3•H2O)>c(HCO3﹣)+c(CO32﹣)+c(H2CO3),故D错误。
故选D。
考查方向
解题思路
A.a点到b点是向饱和氯化钠溶液中通入氨气达到饱和,溶液中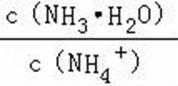
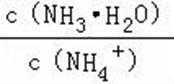
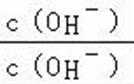
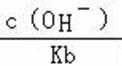
B.b到c点是一水合氨和通入的二氧化碳反应得到碳酸铵溶液,c到d点是碳酸铵和二氧化碳反应生成碳酸氢铵,在溶液中依据溶解度大小最后反应生成碳酸氢钠晶体和氯化铵溶液;
C.c点所示溶液是碳酸铵溶液,图象分析可知溶液显碱性;
D.d点是氯化铵溶液和碳酸氢钠饱和溶液,溶液中存在氮物料守恒,碳元素守恒,析出碳酸氢钠,则溶液中氯离子大于溶液中钠离子。
易错点
本题考查了侯氏制碱法的原理过程分析,盐类水解原理、图象变化和溶液酸碱性的判断等知识,注意产物的理解应用,题目难度中等。
知识点
9.利用下左图所示实验装置可以测定常温常压下气体的摩尔体积。
甲同学利用如上左图装置,根据下列步骤完成实验:①装配好装置,作气密性检查。②用砂纸擦去镁带表面的氧化物,然后取0.108g的镁带。③取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口。④用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平。⑤用注射器吸取10mL3mol·L-1硫酸溶液,用针头扎进A瓶加料口橡皮塞,将硫酸注入A瓶,注入后迅速拔出针头。⑥当镁带完全反应后,读取C瓶中液体的体积,记录数据。⑦用注射器从A瓶加料口处抽出8.0mL气体,使B瓶中导管内外液面持平。⑧读出C瓶中液体体积是115.0mL。完成下列填空:
(1)常温常压下的压强为________,温度为_______。
(2)在常温常压下气体摩尔体积理论值约为24.5L/mol,甲同学测出此条件下lmol气体的体积为________,计算此次实验的相对误差为________%(保留2位有效数字)。引起该误差的可能原因是_________。
a.镁带中含铝;
b.没有除去镁带表面的氧化物;
c.反应放热;
d.所用硫酸的量不足
(3) 丙同学提出可用如上右图装置完成该实验。该装置气密性的检查方法是:_____________。
(4)与原方案装置相比,丙同学使用的装置实验精度更高。请说明理由(回答两条)____________________________________,_____________________________________。
正确答案
(1)101KPa ,25℃(298K)
(2)25.1L 2.5 ac
(3)快速上移或下移水准管,若量气管内液面最终与水准管液面存在稳定的液面差即气密性良好。(其它合理答案也给分下同)
(4)压强:该装置能更简便、更准确地控制气压不变;温度:借助水浴装置,实验温度更接近常温(水浴能减小反应放热带来的误差);精度:量气管由滴定管改制,读数更精确。
解析
(1)常温常压下的压强为101KPa,温度为25℃,
故答案为:101KPa;25℃;
(2)生成氢气的体积为115mL-10mL+8mL=113mL,0.108gMg完全反应得到氢气为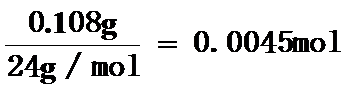
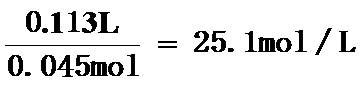
反应放热,气体体积热胀冷缩,Mg中含有Al时,生成氢气体积偏大,导致测定值偏大,没有除去镁带表面的氧化物、所用硫酸的量不足,导致生成氢气体积偏小,导致测定值偏小,故选ac,
故答案为:25.1L;+2.5;ac;
(3)该装置气密性的检查方法是:从水准管中加入水,快速上移或下移水准管,若量气管内液面最终与水准管液面存在稳定的液面差即气密性良好,
故答案为:从水准管中加入水,快速上移或下移水准管,若量气管内液面最终与水准管液面存在稳定的液面差即气密性良好;
(4)与图1相比,该装置能更简便、更准确地控制气压不变,借助水浴装置,实验温度更接近常温(水浴能减小反应放热带来的误差),量气管由滴定管改制,读数更精确,
故答案为:该装置能更简便、更准确地控制气压不变;量气管由滴定管改制,读数更精确等.
考查方向
解题思路
(1)常温常压是指25℃,101KPa;
(2)加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积,可得生成氢气的体积为,根据Mg的质量计算生成氢气物质的量,进而计算气体摩尔体积;
相对误差是指测量所造成的绝对误差与真值之比,再乘以100%所得的数值;
反应放热,气体体积热胀冷缩,Mg中含有Al时,生成氢气体积偏大,导致测定值偏大,没有除去镁带表面的氧化物、所用硫酸的量不足,导致生成氢气体积偏小,导致测定值偏小;
(3)利用液封气体,形成量气管内与水准管内液面存高度差,一定时间内液面差不变,说明气密性良好;
(4)与图1相比,该装置能更简便、更准确地控制气压不变;量气管由滴定管改制,读数更精确等.
易错点
本题中对于测定原理的理解会影响产生氢气的体积数据计算准确性,从而影响到下面的相对误差计算。
知识点
8.下列有关实验的说法正确的是( )
正确答案
解析
A选项容量瓶标有温度、规格、刻度线,量筒标有温度、规格,滴定管温度、规格,量筒、容量瓶无“0”刻度,滴定管有“0”刻度在最上面,使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗,故A正确;
B选项铝放在浓硝酸中会钝化,Al2O3与CuSO4不反应,所以放入硫酸铜中没有什么现象,B错误。
C选项若用浓盐酸配制1:1(体积比)的稀盐酸,通常使用量筒和烧杯即可,不需要使用容量瓶,故C错误
D选项固体碘单质受热易升华为其物理性质,不能说明碘单质的热稳定性较差,D错误。
本题正确答案是A
考查方向
解题思路
A选项容量瓶标有温度、规格、刻度线,量筒标有温度、规格,滴定管温度、规格,量筒、容量瓶无“0”刻度,滴定管有“0”刻度在最上面,使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗,故A正确;
B选项铝放在浓硝酸中会钝化,Al2O3与CuSO4不反应,所以放入硫酸铜中没有什么现象,B错误。
C选项若用浓盐酸配制1:1(体积比)的稀盐酸,通常使用量筒和烧杯即可,不需要使用容量瓶,故C错误。
D选项固体碘单质受热易升华为其物理性质,不能说明碘单质的热稳定性较差,D错误。
B选项不正确,C选项不正确,D选项不正确,所有选A选项。
易错点
实验仪器如计量仪器及使用方法和误差分析。
知识点
7. 在两个固定体积均为1L密闭容器中以不同的氢碳化比




正确答案
解析
A.由图可知,随温度升高CO2的平衡转化率减小,说明升高温度平衡逆向移动,升高温度平衡向吸热反应越大,则正反应为放热反应,故△H<0,而此反应的△S<0,所以由△G=△H-T△S判断该反应应在低温下自发反应故A错误;
B.氢碳比
C.由图可知,P点平衡时二氧化碳转化率为0.5,氢碳比

代入平衡常数表达
D.向处于P点状态的容器中,按2:4:1:4的比例再充入CO2 、H2 、C2H4、H2O后,据等效平衡将C2H4和H2O的量全部转化成CO2 和H2的量后,可得到氢碳比


考查方向
解题思路
A.由图可知,随温度升高CO2的平衡转化率减小,说明升高温度平衡逆向移动,则正反应为放热反应;
B.氢碳比
C.由图可知,P点平衡时二氧化碳转化率为0.5,氢碳比
D.根据据等效平衡将C2H4和H2O的量全部转化成CO2 和H2的量后分析。
易错点
D项中利用等效平衡结合图像分析容易出错
知识点
四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为﹣33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中;再向反应器中缓慢地通入干燥的氯气。
图1 图2
I.图1是实验室制备干燥氯气的实验装置(夹持装置已略)
II.图2是蒸馏SnCl4的装置
17.a的仪器名称 该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,B中发生反应的化学方程式为
18.装置C中饱和食盐水的作用 同时装置C亦是安全瓶,能检测实验进行时D中是否发生堵塞,请写出发生堵塞时C 中的现象
19.试剂X可能为 (填写字母)
20.四氯化锡在潮湿空气中水解的化学方程式
21.用锡花代替锡粒的目的是
22.①蒸馏前若发现烧瓶中液体呈黄色,可采取的措施是
②该装置尚有两处不当之处,它们分别是 ,
③写出III中发生反应的离子方程式
正确答案
分液漏斗Ca(ClO)2+4HCl(浓)= CaCl2+2Cl2↑+2H2O;(2分,无“浓”或“↑”扣1分)[来源:学科网]
解析
由仪器结构特征,可知仪器a为分液漏斗;Ca(ClO)2和浓盐酸反应生成氯化钙、氯气与水,反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,
故答案为:分液漏斗;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
考查方向
解题思路
仪器a为分液漏斗;Ca(ClO)2和浓盐酸反应生成氯化钙、氯气与水;
易错点
四氯化锡遇水强烈水解;U形管中试剂X干燥氯气,不能为碱性干燥剂;若D中发生堵塞,装置内气压增大,c中长颈漏斗中液面上升。
正确答案
除去Cl2中的HCl ; 长颈漏斗中液面上升,形成水柱
解析
制备的氯气中含有HCl,饱和食盐水除去Cl2中的HCl;若D中发生堵塞,装置内气压增大,c中长颈漏斗中液面上升,形成水柱,
故答案为:除去Cl2中的HCl; 长颈漏斗中液面上升,形成水柱;
考查方向
解题思路
制备的氯气中含有HCl,饱和食盐水除去Cl2中的HCl;若D中发生堵塞,装置内气压增大,c中食盐水会被压入长颈漏斗中;
易错点
四氯化锡遇水强烈水解;U形管中试剂X干燥氯气,不能为碱性干燥剂;若D中发生堵塞,装置内气压增大,c中长颈漏斗中液面上升。
正确答案
解析
四氯化锡极易水解,通入的氯气应干燥,U形管中试剂X干燥氯气,不能为碱性干燥剂,可以吸收氯气,不能为液体干燥剂,否则气体不能通过,可以选择氯化钙、五氧化二磷,
故答案为:AD;
考查方向
解题思路
四氯化锡极易水解,通入的氯气应干燥,U形管中试剂X干燥氯气,不能为碱性干燥剂,可以吸收氯气,不能为液体干燥剂,否则气体不能通过;
易错点
四氯化锡遇水强烈水解;U形管中试剂X干燥氯气,不能为碱性干燥剂;若D中发生堵塞,装置内气压增大,c中长颈漏斗中液面上升。
正确答案
SnCl4+2H2O=SnO2+4HCl
解析
四氯化锡遇水强烈水解,根据水解原理可知,应生成Sn(OH)4、HCl,产物之一是固态二氧化锡,说明Sn(OH)4分解生成SnO2与H2O,故水解生成SnO2、HCl,反应方程式为:SnCl4+2H2O=SnO2+4HCl,
故答案为:SnCl4+2H2O=SnO2+4HCl;
考查方向
解题思路
四氯化锡遇水强烈水解,根据水解原理可知,应生成Sn(OH)4、HCl,产物之一是固态二氧化锡,说明Sn(OH)4分解生成SnO2与H2O,故水解生成SnO2、HCl;
易错点
四氯化锡遇水强烈水解;U形管中试剂X干燥氯气,不能为碱性干燥剂;若D中发生堵塞,装置内气压增大,c中长颈漏斗中液面上升。
正确答案
增大与氯气的接触面积,加快反应速率
解析
用锡花代替锡粒的目的是:增大与氯气的接触面积,加快反应速率,故答案为:增大与氯气的接触面积,加快反应速率;
考查方向
解题思路
增大与氯气的接触面积,加快反应速率;
易错点
四氯化锡遇水强烈水解;U形管中试剂X干燥氯气,不能为碱性干燥剂;若D中发生堵塞,装置内气压增大,c中长颈漏斗中液面上升。
正确答案
① 加入锡花
② 温度计水银球位置不对 , Ⅱ和Ⅲ之间缺少干燥装置.
③ Cl2+2OH—=Cl—+ClO—+H2O
解析
①蒸馏前若发现烧瓶中液体呈黄色,说明还有氯气未反应,可采取的措施是加入锡花继续反应,
故答案为:加入锡花;
②温度计水银球位置不对,应再蒸馏烧瓶支管口处;四氯化锡遇水强烈水解,而装置Ⅲ中的水蒸气易进入Ⅱ中,使其发生水解,二者之间缺少干燥装置;
故答案为:温度计水银球位置不对;Ⅱ和Ⅲ之间缺少干燥装置;
③III中主要吸收未反应的氯气,防止污染空气,反应离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,
故答案为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.
考查方向
解题思路
①蒸馏前若发现烧瓶中液体呈黄色,说明还有氯气未反应,加入锡花继续反应;
②温度计水银球位置不对;四氯化锡遇水强烈水解,而装置Ⅲ中的水蒸气易进入Ⅱ中,使其发生水解;
③III中主要吸收未反应的氯气,防止污染空气.
易错点
四氯化锡遇水强烈水解;U形管中试剂X干燥氯气,不能为碱性干燥剂;若D中发生堵塞,装置内气压增大,c中长颈漏斗中液面上升。
5.过量的下列溶液与水杨酸(
正确答案
解析
A.水杨酸与NaHCO3溶液反应时只是-COOH作用转化为-COONa,产物的分子式为C7H5O3Na,A正确;
B.水杨酸与Na2CO3溶液反应时-COOH、-OH均反应,生成产物的分子式为C7H4O3Na2,B错误;
C.水杨酸与NaOH溶液反应时-COOH、-OH均反应,生成产物的分子式为C7H4O3Na2,C错误;
D.与NaCl溶液不反应,D错误;
故选A。
考查方向
解题思路
A.水杨酸与NaHCO3溶液反应时只是-COOH作用转化为-COONa,产物的分子式为C7H5O3Na;
B.水杨酸与Na2CO3溶液反应时-COOH、-OH均反应,生成产物的分子式为C7H4O3Na2;
C.水杨酸与NaOH溶液反应时-COOH、-OH均反应,生成产物的分子式为C7H4O3Na2;
D.与NaCl溶液不反应;
易错点
本题考查有机物的结构和性质,题目难度不大,注意酚羟基、羧基与碳酸酸性的强弱比较,为解答该题的关键。
知识点
扫码查看完整答案与解析