- 有机化合物的异构现象
- 共52题
3.兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物。有一种兴奋剂的结构如图。关于它的说法中不正确的是( )
正确答案
解析
A、该有机物中含有羧基,所以能发生酯化反应。正确。
B、在该物质的中含有除碳氧以外的元素,错误。
C、由于该物质分子中含有碳碳双键和苯环,可以与氧气发生加成反应,该反应也是还原反应,还可以发生燃烧反应即氧化反应,正确。
D、由于羧基有特殊的稳定性,不能发生加成反应,所以1mol该物质最多跟5mol氧气发生反应,正确。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
有机物性质混淆
知识点
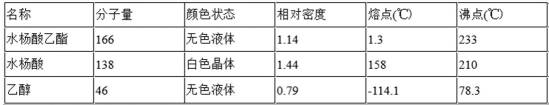
水杨酸乙酯为无色油状液体,呈淡的冬青油香气。沸点234℃,熔点1.3℃。溶于乙醇、乙醚、醋酸和大多数非挥发性油,微溶于水和甘油。用于有机合成或配制香料,也用作溶剂。某化学小组用水杨酸(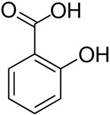
实验步骤:
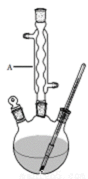
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和34.5 g(44 mL,0.75 mol)乙醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在95~100℃下恒温加热反应5小时:
Ⅱ.待装置冷却后,分离出乙醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集233℃的馏分,得水杨酸乙酯12.40g。
常用物理常数:
请根据以上信息回答下列问题:
8.仪器A的名称是 ,加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
9.制备水杨酸乙酯时,最合适的加热方法是 。
10.实验中加入甲苯对合成水杨酸乙酯的作用是 。
11.反应结束后,分离出乙醇采用的方法是 。
12.实验中加入无水硫酸镁的作用是 。本实验的产率为 (保留三位有效数字)。
正确答案
球形冷凝管 防止暴沸 停止加热,待冷却后加入
解析
仪器A的名称是球形冷凝管,加入沸石的作用是防止暴沸。若加热后发现未加沸石,应采取的正确方法是停止加热,待冷却后加入。
解题思路
若加热后发现未加沸石,应采取的正确方法是停止加热,待冷却后加入;
易错点
本题侧重于有机物的分离提纯,题目难度不大,注意二者官能团的结构以及性质的异同。
正确答案
水浴加热
解析
制备水杨酸乙酯时,95~100℃最合适的加热方法是水浴加热;
考查方向
解题思路
制备水杨酸乙酯时,95~100℃最合适的加热方法是水浴加热;
易错点
本题侧重于有机物的分离提纯,题目难度不大,注意二者官能团的结构以及性质的异同。
正确答案
加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率
解析
实验中加入甲苯作带水剂的目的是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少乙醇的用量,从而提高反应的产率;
考查方向
解题思路
实验中加入甲苯作带水剂的目的是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少乙醇的用量,从而提高反应的产率;
易错点
本题考查侧重于有机物的分离提纯,题目难度不大,注意二者官能团的结构以及性质的异同。
正确答案
蒸馏或水洗分液
解析
因为乙醇的沸点低,分离乙醇的操作是蒸馏;
考查方向
解题思路
因为乙醇的沸点低,分离乙醇的操作是蒸馏;
易错点
本题考查有机物的结构和性质,侧重于有机物的分离提纯,题目难度不大,注意二者官能团的结构以及性质的异同。
正确答案
除水或干燥 74.7%
解析
实验中加入无水硫酸镁的作用是除水或干燥;乙醇过量,13.8g (0.1 mol)水杨酸应得到0.1mol水杨酸乙酯,即16.6g,产品的质量为12.40 g,故所得水杨酸乙酯的产率为12.40 g/16.6g=74.7%。
考查方向
解题思路
实验中加入无水硫酸镁的作用是除水或干燥;13.8g (0.1 mol)水杨酸应得到0.1mol水杨酸乙酯,即16.6g,产品的质量为12.40 g,故所得水杨酸乙酯的产率为74.7%。
易错点
本题考查有机物的结构和性质,侧重于有机物的分离提纯,题目难度不大,注意二者官能团的结构以及性质的异同。
[化学—选修2:化学与技术]
纯碱是造纸、玻璃、纺织、制革等行业的重要原料。
23.路布兰法制备纯碱:①食盐与硫酸反应生成硫酸钠:②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成。第②步反应的化学方程式为_______。
24.索尔维法制纯碱的主要工艺流程如下,石灰石用于制备CO2和石灰乳。
①原盐水中含少量Mg2+和Ca2+,结合生产实际,精制盐水需要的试剂是________、________。(填化学式)
②步骤Ⅱ保持在30~35℃进行,反应的化学方程式为_________,该反应能发生的原因 是________。该工艺中循环利用的物质是____________。
③索尔维法制纯碱不需要用到的一种设备是__________(填正确答案标号)。
A.吸氨塔
B.蒸氨塔
C.碳酸化塔
D.沸腾炉
E.石灰窑
④该工艺中食盐利用率大约只有70%,食盐损失的主要原因是________。我国科学家 侯德榜将合成氨工业得到的NH3和CO2引入纯碱的生产,向上述工艺的“母液”中通入NH3,并加入食盐固体,降温结晶得到副产品__________(填化学式),剩余母液返回“吸氨”步骤,大大提高了食盐的利用率。
25.纯碱产品中可能含有碳酸氢钠。用热重分析的方法测定纯碱中碳酸氢钠的质量分数为ω(NaHCO3)=________(列出算式,所需数据用字母表示,并说明各字母的含义)。
正确答案
Na2SO4+CaCO3+4C 
解析
②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成——反应物有硫酸钠、石灰石和碳,生成物有碳酸钠和硫化钙,有硫的化合价降低、就有碳的化合价升高、且在高温下——还有生成物CO。故第②步反应的化学方程式为:Na2SO4+CaCO3+4C 
考查方向
解题思路
依据物质性质、反应规律、化学工艺流程等解题
易错点
第②步反应的化学方程式的书写
正确答案
① Ca(OH)2(或CaO) Na2CO3
② NH3·H2O+NaCl+CO2=NaHCO3↓+NH4Cl
常温下,NaHCO3、NH4Cl、NH4HCO3、NaCl四种物质中,NaHCO3溶解度最小 CO2 NH3
③ D
④ NaHCO3未完全析出,母液中的Na+随废液排出 NH4Cl
解析
索尔维法制纯碱的主要工艺流程如下,石灰石用于制备CO2和石灰乳。 ①原盐水中含少量Mg2+和Ca2+,结合生产实际,精制盐水,即食盐的精制——Mg2+用NaOH沉淀、Ca2+需Na2CO3沉淀。但结合上述流程,只有石灰石、石灰乳、Na2CO3等,故Mg2+应改用Ca(OH)2或CaO沉淀,所以需要的试剂是Ca(OH)2(或CaO) 、Na2CO3。
②步骤Ⅱ保持在30~35℃进行,反应的化学方程式为NH3·H2O+NaCl+CO2=NaHCO3↓+NH4Cl,该反应能发生的原因是:常温下,NaHCO3、NH4Cl、NH4HCO3、NaCl四种物质中,NaHCO3溶解度最小。该工艺中循环利用的物质可从流程图中的返回箭头(从右向左的)看出:是CO2、NH3。
③在题述5种设备中,很明显的是D.沸腾炉——是接触法制硫酸的三大设备之一,故索尔维法制纯碱不需要用到的。
④食盐损失的主要原因是:NaHCO3仍有一小部分溶解在溶液中,故NaHCO3未完全析出,母液中的Na+随废液排出。侯德榜将合成氨工业得到的NH3和CO2引入纯碱的生产,向上述工艺的“母液”中通入NH3,并加入食盐固体,降温结晶得到副产品:即上述反应的另一生成物NH4Cl(且注意填化学式)。
考查方向
解题思路
依据物质性质、反应规律、化学工艺流程等解题
正确答案
84(m1—m2)/31m1 m1是样品质量,m2是样品受热分解后的质量
解析
纯碱产品中可能含有碳酸氢钠。设纯碱样品质量为m1,样品经充分受热分解后的质量为m2。依据: 2NaHCO3 = Na2CO3+CO2↑+H2O △m(反应前后固体质量差)
2×84 g 62 g
m(NaHCO3) m1—m2
m(NaHCO3)= 2×84(m1—m2)/ 62=84(m1—m2)/ 31
纯碱中碳酸氢钠的质量分数为ω(NaHCO3)=84(m1—m2)/ 31÷m1
=84(m1—m2)/31m1(或×100%)。
考查方向
解题思路
依据物质性质、反应规律、化学工艺流程等解题
6.85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖。颁奖
理由是“因为发现青蒿素── 一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生
命。”下列关于青蒿素和双氢青蒿素(结构如图)说法错误是( )
正确答案
解析
A选项注意结构简式中碳与氢的数目,经计算正确。
由青蒿素制备双氢青蒿素是酯基上的碳氧双键断裂加氢,反应属还原反应,B正确。
双氢青蒿素中无酯基不能与氢氧化钠反应,故C错误。
青蒿素分子中的确含有三种含氧官能团,D正确。
考查方向
解题思路
认真审题,对比青蒿素与双氢青蒿素的结构找出二者的不同点,熟悉常见官能团的结构与性质。
易错点
判断分子式时粗心,漏算C、H。对官能团判断不清。
知识点
化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
19.目前工业上常用甲烷自热重整制氢,根据下图写出合理的热化学方程式______________________________。
20.在恒容密闭容器中通入CH4与CO2,使其物质的量浓度为1.0mol/L,在一定条件下发生反应:CO2(g) + CH4(g) 
则:①该反应的△H 0(填“<、= 或>”);
21.②压强P1、P2、P3、P4由大到小的关系为 。压强为P4时,在b点:v(正) v(逆)。(填“<、= 或>”)
22.对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp= ;如果P4=0.36MPa,求a点的平衡常数Kp= ;(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。图为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度 关系曲线:v正~c(CH4)和v逆~c(CO)。
则:ⅰ)与曲线v正~c(CH4)相对应的是上图中曲线 (填“甲”或“乙”)。
ⅱ)当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为 (填字母)。
23.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
Na2Sx
①判断该电池工作的适宜温度应为________。
24.关于钠硫电池,下列说法正确的是________。
25.25 ℃时,若用钠硫电池作为电源电解500 mL 0.2 mol·L-1 NaCl溶液,当溶液的pH变为13时,电路中通过的电子的物质的量为________ mol,两极的反应物的质量差为________ g。(假设电解前两极的反应物的质量相等)
正确答案
CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1
解析
该反应为CH4(g)+H2O(g)===CO(g)+3H2(g),由图可知ΔH=1+3-21
考查方向
解题思路
由图可知,CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1
易错点
由图形分析反应热的计算。
正确答案
① >;
解析
图可知,温度升高甲烷的平衡转
考查方向
解题思路
温度升高甲烷的平衡转
易错点
注意反应CH4的平衡转化率与温度及压强的关系图;。
正确答案
② p4> p3> p2 >p1 (1分) ;>(1 分)
解析
②由该反应式可知,增大压强有助于反应向逆反应方向进行,所以从P1到P4压强依次增大,由图可知此时该反应还在向正反应方向进行着,所以正反应速率大于逆反应速率。
考查方向
解题思路
②增大压强有助于反应向逆反应方向进行。
易错点
注意反应CH4的平衡转化率与温度及压强的关系图;。
正确答案
③ P2(CO)·P2(H2)/(P(CO2) ·P(CH4)) ;1.64(MPa)2 甲 a
解析
由图可知,浓度增大一点,乙曲线对应的反应速率增大的非常迅速,所以乙曲线对应甲烷的反应速率曲线。
考查方向
解题思路
④浓度增大一点,乙曲线对应的反应速率增大的非常迅速。T1℃时,若改变反应条件,导致NO浓度增大,则改变的条件可能是增加NO的量;缩小容器体积;升温。
易错点
注意化学平衡状态的判断;。
正确答案
解析
关于钠硫电池,放电时,电极A为负极;据表知,该电池工作的适宜温度应为300 ℃~350 ℃
考查方向
解题思路
根据表格判断温度范围。
易错点
电极反应式书写,根据电解质确定正负极产物。。
正确答案
解析
关于钠硫电池,放电时,电极A为负极;Na+的移动方向为从A到B;充电时,电极A应连接电源的负极;电极B的电极反应式为S-2e-===xS
考查方向
解题思路
于钠硫电池,放电时,电极A为负极;Na+的移动方向为从A到B;充电时,电极A应连接电源的负极;。
易错点
电极反应式书写,根据电解质确定正负极产物。。
正确答案
0.05 2.3
解析
电路中转移电子的物质的量为0.5 L×0.1 mol·L-1=0.05 mol,负极减小0.05 mol×23 g·mol-1=1.15 g,正极增加的质量也是Na的质量,所以两极的反应物的质量差为2.3 g。
考查方向
解题思路
于钠硫电池,放电时,电极A为负极;Na+的移动方向为从A到B;充电时,电极A应连接电源的负极;。
易错点
电极反应式书写,根据电解质确定正负极产物。。
扫码查看完整答案与解析