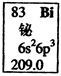- 原子核外电子排布
- 共93题
(1)中国古代四大发明之一——黑火药,它的爆炸反应为
2KNO3+3C+S
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
③已知



(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,
(3


[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+
交换出来的
将含0.0015 mol 

正确答案
(1)①

(2)
(3)
解析
(1)①钾为活泼金属,电负性比较小;C、N、O在同周期,非金属性逐渐增强,电负性也逐渐增大;②











(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,应该都属于元素Ⅷ,原子序数T比Q多2,可以确定T为




(3)中和生成的




知识点
元素周期表中铋元素的数据见右图,下列说法正确的是
正确答案
解析
本题考查原子结构,意在考查考生对元素周期表知识记忆的再现。由元素周期表中元素方格中各种符号、数字的意义可知Bi的质子数为83,因不知中子数,无法确定其质量数,A项错误;Bi的相对原子质量为209.0,B项正确;6p亚层有3个未成对电子,C项错误;最外层5个电子分别在s、P层,能量不同,D项错误。
知识点
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1molCO2中含有的σ键数目为 。
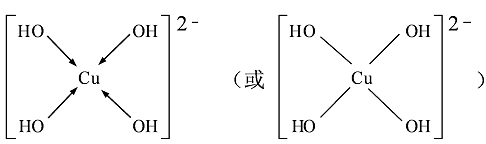
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
正确答案
见解析。
解析
(1)①1s22s22p63s23p63d5(或[Ar]3d5)
②平面三角形
(2)①C≡O ②sp3 ③2×6.02×1023个(或2mol)
(3)
本题科学研究铜锰氧化物作背景,考查学生对电子排布、原子轨道杂化类型与空间构型、等电子体原理、[Cu(OH)4]2-结构等《选修三》基础知识的掌握和应用能力。本题基础性较强,重点特出。
知识点
(一)下列有关元素锗及其化合物的叙述中正确的是
A.锗的第一电离能高于碳而电负性低于碳
B.四氯化锗与四氯化碳分子都是四面体构型
C.二氧化锗与二氧化碳都是非极性的气体化合物
D.锗和碳都存在具有原子晶体结构的单质
(二)铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g·cm-3,则铜晶胞的体积是
cm3、晶胞的质量是 g,阿伏加德罗常数为 (列式计算,己知Ar(Cu)=63.6);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方应程式为 。
正确答案
(一) BD
(二)
(1)1s22s22p63s23p63d104s1
(2)4.7×10-23cm3 4.23×10-22g Ar(Cu)=63.6g/mol=×NA,得NA=6.01×1023mol-1。
(3)sp3 K2CuCl3
(4)过氧化氢为氧化剂,氨与Cu形成配离子,两者相互促进使反应进行。
解析
(一)锗是金属而碳是非金属元素,第一电离能要低于碳,故A错;C和Ge都是第ⅣA族元素,四氯化锗与四氯化碳都是分子晶体,其分子构型相同,故B正确;锗是金属,金属的氧化物不可能为气体化合物,故C错;锗和碳是同主族元素,晶体结构具有一定的相似性,故D正确。
(二)
(1)铜是29号元素,其基态原子的电子排布式为:1s22s22p63s23p63d104s1。
(2)铜的晶胞为面心立方最密堆积,一个晶胞能分摊到4个Cu原子;1pm=10-10cm,故一个晶胞的体积为(361×10-10cm)3=4.7×10-23cm3;一个晶胞的质量为4.7×10-23cm3×9.00g·cm-3=

(3) KCuCl3中Cu元素的化合价为+2,则另一种无限长链结构中的Cu元素的化合价为+1,CuCl3原子团的化合价为-2,故其化学式为K2CuCl3。
(4)“金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应”,这是两种物质共同作用的结果:过氧化氢具有强氧化性,而氨水能与Cu2+形成配合物。
知识点
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是_____。
(2)XY2-离子的立体构型是_______;R2+的水合离子中,提供孤电子对的是原子是______。
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是___________。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________。
正确答案
(1)①1s22s22p4
②Cl
(2)①V 形
②O
(3)2:1
(4)2Cu+NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
解析
(1) 通过红棕色气体 XY2 以及氢化物 XH3 推断出 X 为 N 元素, Y 为 O 元素,故 Y 元素的电子排布式为1s22s22p4;通过 Z 的基态原子的 M 层与 K 层电子相等,推断出 Z 原子核外有 12 个电子,故 Z 为 Mg元素,故 Z 所在周期为第三周期,第三周期中第一电离能最大的元素为 Cl 元素;
(2)XY2-为 NO2-离子,中心氮原子采取 sp2杂化,且有一对孤对电子,故空间构型为 V 形;根据 R2+离子的 3d 轨道中有九个电子可知,R 的价电子排布式为 3d104s2,故 R 为 Cu 元素,故水合铜离子中提供故对电子的原子为水分子中的氧原子,铜离子提供给空轨道;
(3)根据晶体图形可知,角上占 1/8,面心占 1/2,体心占 1,故可知晶胞中阴、阳离子个数比为 2:1
(4) 由前两问可知,该反应为 Cu 在浓氨水中与氧气反应生成[Cu(NH3)4](OH)2 的反应方程式,故离子方程式为:2Cu+NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
知识点
A、B、C、D、E、F均为周期表中前四周期的元素。请按要求回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
下列有关A、B的叙述不正确的是______________。
a,离子半径A<B
b,电负性A<B
c,单质的熔点A>B
d,A、B的单质均能与某些氧化物发生置换反应
e,A的氧化物具有两性
f,A、B均能与氯元素构成离子晶体
(2)C是地壳中含量最高的元素,C基态原子的电子排布式为_______。
(3)E元素原子的最外层电子数是其次外层电子数的2倍,则乙醇分子中E原子的杂化方式是__________。E的一种单质具有空间网状结构,晶胞结构如右图2。已知位于晶胞内部的4个原子,均位于体对角线的

(4)F与硒元素同周期,F位于p区中未成对电子最多的元素族中,F原子的价电子排布
图为_________;
“>”或“<”“=”
正确答案
答案:
(1)bf (2)1s22s22p4 12 (3) sp3
(4)
解析
略
知识点
16O和18O是氧元素的两种核素,NA表示阿弗加德罗常数,下列说法真确的是
正确答案
解析
A中的两种物质是同一种物质,都是氧气,故A错;B中的两种氧原子的电子数相等,核外电子排布也相等,故B错;16O、18O之间的转换,是原子核的变化,故C错;11.2L标况下的O2物质的量为0.05mol,含有的氧原子数为0.1NA,故D正确。
知识点
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。
(1)基态硼原子的电子排布式为_________。
(2)关于这两种晶体的说法,正确的是_________(填序号)。
a. 立方相氮化硼含有σ键和π键,所以硬度大
b. 六方相氮化硼层间作用力小,所以质地软
c. 两种晶体中的B-N键均为共价键
d. 两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为_________,其结构与石墨相似却不导电,原因是_________。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为_________。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是_________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有_________mol配位键。
正确答案
(1)1s22s22p1
(2)b、c
(3)平面三角形;层状结构中没有自由移动的电子
(4)sp3;高温、高压
(5)2
解析
略。
知识点
早期发现的一种天然二十面体准晶颗粒由AI.Cu.Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体.准晶体和非晶体。
(2)基态 Fe原子有 个未成对电子,Fe3+的电子排布式为 可用硫氰化钾检验Fe3+,形成的配合物的颜色为_ 。
(3)新制备的Cu(OH)2可将乙醛〔CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为_ ,1mol乙醛分子中含有的σ健的数目为_ 。乙酸的沸点明显高于乙醛,其主要原因是 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_ 个铜原子。
(4)Al单质为面心立方晶体,,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_ 。列式表示Al单质的密度_ g·cm-3〔不必计算出结果)。
正确答案
(1)X-射线衍射
(2)4 
(3)

6

16
(4) 12

解析
略
知识点
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
正确答案
解析
短周期中最外层电子数是次外层电子数一半的有Li:

知识点
扫码查看完整答案与解析