- 原子核外电子排布
- 共93题
请从36~38题中任选一题作答
36.[化学—选修:化学与技术]
SO2.NO是大气污染物。吸收SO2 和NO,获得

(1)装置Ⅰ中生成
(2)含硫各微粒(


①下列说法正确的是( )(填字母序号)。
a.pH=8时,溶液中
b.pH=7时,溶液中
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:( )。
(3)装置Ⅱ中,酸性条件下,NO被

(4)装置Ⅲ的作用之一是再生
①生成
②生成
(5)已知进入装置Ⅳ的溶液中,


37.[化学—选修:物质结构与性质]
在5-氨基四唑(
(1)基态Ga原子的电子排布式可表示为( );
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为( );在1mol 5-氨基四唑中含有的σ键的数目为( )
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的 空间构型为( )。
②以四氯化钛.碳化钙.叠氮酸盐作原料,可以生成碳氮化钛化合物.其 结 构是用碳原子取代氮化钛晶胞(结构如上图示)顶点的氮原子,这种碳氮化钛化合物的化学式为( )。
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 ( )。(填写元素符号)
④ [Ti(OH)2(H2O)4]2+中的化学键有( )。
a.σ键 b.π键 c.离子键 d.配位键
38.[化学—选修:有机化学基础]
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N(部分产物及反应条件已略去)。
(1)生成M、N的反应类型分别是( ),( ); D的结构简式是 ( )。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。C的结构简式是( )。
(3)由苯酚生成A的化学方程式是 ( ) 。B与C反应的化学方程式是( )。
(4)以苯酚为基础原料也可以合成芳香族化合物F。经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31.6%,F完全燃烧只生成

已知:①芳香族化合物F能发生银镜反应,且还能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③分子结构中不存在“-O-O- ”的连接方式。F的结构简式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.“C1化学”是指以研究分子中只含一个碳原子的化合物为原料来合成一系列化工原料和燃料的化学。
(1)煤的气化是获得合成气的一种方法,写出煤气化的主要化学反应方程式:( );
(2)天然气的重整的化学反应方程式为 ( );
(3)最近科学家提出一种“绿色自由’’构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为甲醇。其技术流程如下:
①碳酸钾溶液所起的作用是( );
②写出上述流程中分解池中发生反应的化学方程 ( );
③写出合成塔中发生的化学反应方程式( );
④“绿色自由”构想技术流程中常包括物质和能量的循环利用,上述流程中能体现循环利用的物质有 ( ) 。
37.在电解炼铝过程中加入冰晶石(用“A”代替),起到降低Al2O3的熔点等诸多作用,冰晶石的生产原理如下:
根据题意完成下列填空:
(1)冰晶石的化学式为 ( ),含有离子键、( )化学键;
(2)生成物中含有10个电子的分子是( )(写分子式),该分子的空间构型为 ( ),中心原子的杂化方式为( );
(3)反应物中电负性最大的元素为( ),写出其原子最外层的电子排布图:( )
(4)冰晶石由两种微粒构成,冰晶石晶胞结构如图丁所示,位于大立方体顶点和面心,位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )(填具体的微粒符号)
(5)Al单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,请回答:
一个晶胞中Al原子的数目为( );Al晶体的密度为( )(用字母表示)
38.酒石酸(tartaric acid),即,2,3-二羟基丁二酸,是一种羧酸﹐存在于多种植物中﹐也是葡萄酒中主要的有机酸之一。作为食品中添加的抗氧化剂﹐可以使食物具有酸味。酒石酸最大的用途是饮料添加剂。也是药物工业原料,以烃A为原料合成酒石酸的流程如下:
已知:① 烃A中碳氢质量比为8:1
②
③ D的分子组成是C4H8O2Cl2,核磁共振氢谱显示其有三个峰。
(1)A的名称为: ( ),分子中最多有( )原子共面;
(2)B中所含官能团的名称是( ),B存在顺反异构,它的顺式结构为( );
(3)C转化为D的反应类型是( ),
F转化为G的化学反应方程式是 ( );
(4)F与乙二醇在一定条件下可以发生缩聚反应,该反应的化学方程式是___________
(5)C的同分异构体有多种,其中含有“—COO—”结构的有( )种;
(6)欲得到较纯净的酒石酸,需将G从其溶液中分离提纯,查阅相关资料得知G的溶解度受温度影响较大,则分离提纯G的方法是( )。
36.请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。“C1化学”是指以研究分子中只含一个碳原子的化合物为原料来合成一系列化工原料和燃料的化学。
(1)煤的气化是获得合成气的一种方法,写出煤气化的主要化学反应方程式:
;
(2)天然气的重整的化学反应方程式为 ;

①碳酸钾溶液所起的作用是 ;
②写出上述流程中分解池中发生反应的化学方程 ;
③写出合成塔中发生的化学反应方程式 ;
④“绿色自由”构想技术流程中常包括物质和能量的循环利用,上述流程中能体现循环利用的物质有 。
37.在电解炼铝过程中加入冰晶石(用“A”代替),起到降低Al2O3的熔点等诸多作用,冰晶石的生产原理如下:
2Al(OH)3+ 12HF+ 3 Na2CO3 = 2A+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)冰晶石的化学式为 ,含有离子键、 等化学键;
(2)生成物中含有10个电子的分子是 (写分子式),该分子的空间构型为 ,中心原子的杂化方式为 ;
(3)反应物中电负性最大的元素为 ,写出其原子最外层的电子排布图:



体心处▽所代表的微粒是 (填具体的微粒符号)

下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,请回答:
一个晶胞中Al原子的数目为 ;Al晶体的密度为 (用字母表示)
38.酒石酸(tartaric acid),即,2,3-二羟基丁二酸,是一种羧酸﹐存在于多种植物中﹐也是葡萄酒中主要的有机酸之一。作为食品中添加的抗氧化剂﹐可以使食物具有酸味。酒石酸最大的用途是饮料添加剂。也是药物工业原料,以烃A为原料合成酒石酸的流程如下:
已知:① 烃A中碳氢质量比为8:1
②
③ D的分子组成是C4H8O2Cl2 ,核磁共振氢谱显示其有三个峰。
(1)A的名称为: ,分子中最多有 个原子共面;
(2)B中所含官能团的名称是 ,B存在顺反异构,它的顺式结构为 ;
(3)C转化为D的反应类型是 ,
正确答案
正确答案
正确答案
请从36~38题中任选一题作答
36.【化学—选修2:化学与技术】
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
Ⅰ.氮的化合物是重要的化工产品。其生产方法也在逐渐改进中,各国科学家均在为提高其产量,降低能耗做各种有益的探究。
(1)25℃时合成氨反应热化学方程式为:

(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是( );与传统的合成氨的方法比较,该方法的优点是( )。
Ⅱ.(3)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到
c.在

d.将
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是( ) 。
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(4)铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中 ( )的U4+,而不吸附其他元素。其反应原理为( )(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为:( ) 。
37.【化学—物质结构与性质】
许多金属及它们的化合物在科学研究和工业生产中具有许多用途.回答下列有关问题:
(1)基态Ni核外电子排布式为( ), 第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是( );
(2)



(3)另一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为( ),若该晶胞的边长为a pm,则合金的密度为( ) 
38.【化学——选修5:有机化学基础】
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去)
(1)苯酚的俗名是( )。B的官能团名称( )。
(2) 已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。B与C反应的化学方程式是( ) 。
(3)生成N的反应方程式( ) 。
(4)以苯酚为基础原料也可以合成有机物E。已知E的相对分子质量为122,其中氧元素的质
量分数为26.23%,E完全燃烧只生成

(5)已知E具有如下结构特征:


(6)物质F如图,则符合下列条件F的同分异构体有( )种。
①能发生银镜反应②能与

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅰ的化学方程式 ( ) 。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是( )。
(3)下列有关说法正确的是( ) 。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是( )。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式( ) 。37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为___ ___。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为 ___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为__ __。38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( ) 。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写
(4)已知:R-C

R-ONa
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是 ( ),反应II的反应类型是 ( ) 。
③反应IV的化学方程式是( ) 。
37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为______。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为____。
38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( )。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 ( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)( ) 。
(4)已知:
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是( ),反应II的反应类型是( ) 。
③反应IV的化学方程式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36. 硫酸铁铵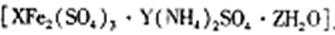
请回答下列问题:
(1)操作甲名称:( );操作乙名称:( )。
(2)硫酸亚铁溶液加硫酸酸化主要目的是 ( );滤渣A主要成分是();
(3)①试剂B最适宜的是()(填序号)
A.NaClO B.H2O2 C.酸化的KMnO4 D.K2Cr2O7
②除杂原理是( )(用离子方程式表示)
③若要检测Fe2+是否氧化完全,方法是( );能否用酸化的KMnO4溶液 ( ) (填“能”或“不能”),理由是 ( ) 。
(4)称取14.0g样品,配成100ml溶液,分成二等份,向一份加入足量NaOH溶液,过滤,洗涤,干燥得2.14g沉淀;另一份加入0.05mol Ba(NO3)2,恰好完全反应,则该产品化学式为 ( )。
37.A、B、C、D为原子序数依次增大的短周期元素。已知:
①A原子核外电子有5种运动状态;
②B是地壳中含量最多元素;
③A、C、D未成对电子数之比为1:3:1:
④E有生物金属之称,E4+与氩原子核外电子排布相同;
请回答下列问题:
(1)D原子价电子层结构为 ( ) ;基态E原子的核外电子排布式:( );
(2)5种元素所形成XY3型化合物化学式可能为( )、( );其中心原子杂化方式为 ( );
(3)与C周期相同的金属元素分别处于( )区;
(4)由B、D构成的以D为中心三原子分子的空间构型为 ( ) ;
(5)下列晶体的堆积方式与E单质晶体堆积方式相同的是( );
A.Po B.Zn C.Ag D.K
(6)B形成的两种同素异形体中在水中溶解度更大的是( )(填化学式);原因是( )。
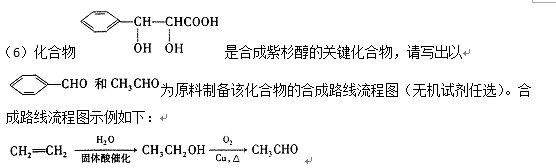
38.我国科研人员从天然姜属植物分离出一种具有显著杀菌、消炎、解毒作用的化合物H,H的合成路线如下:
(1)A→B的反应类型是 ( )。
(2)化合物B中的含氧官能团为 ( ) 和( )(填官能团名称)。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式:( ) 。
I.苯环上有两个取代基 II,分子中有6种不同化学环境的氢
Ⅲ.既能与FeCl3溶液发生显色反应,又能发生银镜反应,水解产物之一也能发生银镜反应
(4)实现F→G的转化中,加入的化合物X( C12H14O3)的结构简式为 ( ) 。
(5)写出F与新制氢氧化铜悬浊液反应的化学方程式: ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析