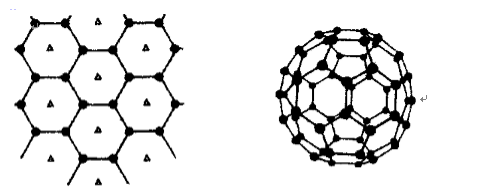
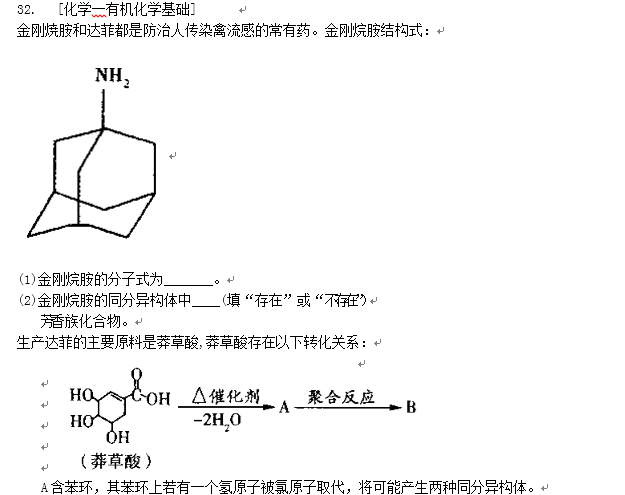
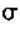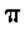- 原子核外电子排布
- 共93题
其中第28、29题为物理题,第30、31题为化学题。考生从两道物理、两道化学题中各任选一题作答。
30.(选考——物质结构与性质)
X、Y、Z、Q为短周期非金属元素, R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为( ) 。
(2) X、Y、Z三种元素第一电离能从大到小顺序为( )。
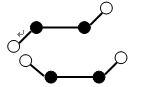
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是( )
A. 仅1个σ键
B. 1个σ键和2个π键
C. 1个σ键和1个π键
D. 仅2个σ键
②该分子中Y原子的杂化方式是( )
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式
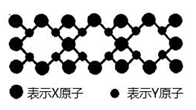
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 ( )
A. 该晶体属于分子晶体
B. 此晶体的硬度比金刚石还大
C. 晶体的化学式是X3Y4
D. 晶体熔化时共价键被破坏,没有克服范德华力和氢键
31.(选考——有机化学基础)
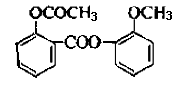
醋柳酯是一种镇咳祛痰药。用于上呼吸道感染、感冒咳嗽、急慢性支气管炎症等的治疗,其结构简式如右。回答下列问题:
(1)醋柳酯的分子式为 ( )。
(2)关于醋柳酯说法正确的是为( )
A.是高分子化合物
B.可与氢气发生加成反应
C.不能发生银镜反应
D.能发生水解反应且只生成2种有机物
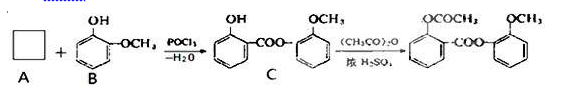
(3)醋柳酯可由下图所示路线合成
①中间产品C中混有反应物A和B,检验C中含有A的反应可以是(用化学反应方程式表示)
②写出C和足量NaOH溶液反应的化学方程式( )。
③A的同分异构体很多,写出属于酯类,且能与FeCl3反应显紫色的同分异构体的结构简式是( )。
30. (选考——物质结构与性质)
X、Y、Z、Q为短周期非金属元素, R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为 。
(2) X、Y、Z三种元素第一电离能从大到小顺序为 。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):

正确答案
第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
30.【化学——物质结构与性质】
金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(1)请解释金属铜能导电的原因
Cu2+的核外电子排布式为__________________________。
(2)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
①胆矾中含有的化学键有 ( )(填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
②有关胆矾说法正确的是( )
A.结晶水中的氧原子采用SP2杂化; B.硫酸根离子为正四面体形;
C.胆矾中的水在不同温度下会分步失去;
③胆矾受热分解得到铜的某种氧化物,其晶胞结构如图所示,则该氧化物的化学式 ( )。
(3)已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个 Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+ 的空间构型为( ) 。
31.【化学——有机化学基础】
已知:一个碳原子上连多个羟基时不稳定,
烃A含有碳碳叁键,且有如图的转化关系:
(1)写出物质C的结构简式:_____________________,指出反应⑥的反应类型:____________。
(2)D中含氧官能团的名称为_____________________________。
(3)写出C与银氨溶液反应的化学反应方程式: ______________________________________
(4)与G具有相同官能团的同分异构体有四种,其中两种为:
请写出其他两种( )、( )。
30.【化学——物质结构与性质】
金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(1)请解释金属铜能导电的原因
正确答案
第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
30.[化学一物质结构与性质]
氟、氯、溴、碘4种元素同属于周期表中第VIIA族。
(1)4种元素中电负性最小的基态原子的价电子排布式是 .
(2)氢氟酸是弱酸的原因是____。
(3)氯元素可广泛存在于无机物和有机物中。二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是____,氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 ( )(填“极性”或“非极性”)分子。
(4)冰晶石(Na3AlF6)主要用作电解Al2O33生产铝的助熔剂,其晶体不导电,但熔融时能导电。在冰晶石(Na3AlF6)晶体中存在( )(填选项)。
A.离子键 B.极性键 C.配位键 D.范德华力
(5)氰[(CN)2]是一种分子构型和化学性质与卤素单质很相似的化合物,称为拟卤素。一个氰分子中含有____个π键。
31.[化学一有机化学基础]
化合物A,B可合成荧光“魔棒”中产生能量的物质之一
(CPPO)。
请回答:
(1)A分子中官能团的名称____.
(2)化合物A可通过以下步骤合成:
写出反应②的化学方程式________;属于____反应(反应类型):
(3)B水解后的芳香族化合物C(C7H3Cl3O3)的结构简式____,
(4)B水解后的另一种化合物D,与D同类且含一个支链的同分异构体有____种:
(5)已知D不能发生消去反应,与乙酸、浓硫酸共热生成有香味的物质。写出该反应的化学方程式____ 。
30.[化学一物质结构与性质]
氟、氯、溴、碘4种元素同属于周期表中第VIIA族。
(1)4种元素中电负性最小的基态原子的价电子排布式是 .
(2)氢氟酸是弱酸的原因是____ 。
(3)氯元素可广泛存在于无机物和有机物中。二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是____,氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 (填“极性”或“非极性”)分子。
(4)冰晶石(Na3AlF6)主要用作电解Al2O33生产铝的助熔剂,其晶体不导电,但熔融时能导电。在冰晶石(Na3AlF6)晶体中存在 (填选项)。
正确答案
第29、30题为物理题,第31、32题为化学 题,考生从两道物理题、两道化学题中各任选一题作答。
31.[化学——物质结构与性质]
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+N2H62+等。
回答以下问题:
(1)某元素原子与N3_含有相同的电子数,其基态原子的价电子排布式是_______。
(2) C、N、O三种元素第一电离能从大到小的顺序是_______。
(3)肼@2H4)分子可视为NH3分子中的一个氢原子被一NH2 (氨基)取代形成的另
一种氮的氢化物。NH3分子的空间构型是_______; N2H4分子中氮原子轨道的杂化类型是_______
(4)胼能与硫酸反应生成N2H6S04。N2H6S04晶体类型与硫酸铵相同,则N2H6S04的晶体内不存在_______(填标号)
a.离子键b.共价键 c.配位键 d.范德华力
(5)NH3.N2H4、NH4' N2H62+四种微粒中,能形成氢键的有_______;不能作为配位体的有_______。
32.[化学——有机化学基础]
丙烯可合成高吸水性聚丙烯酸钠树脂,下面是丙烯合成聚丙烯酸钠的化工流程。回答..
(1)丙烯的分子式为( )
(2)丙烯不哮发生的有机反应类型有_______ (填数字序号λ
①取代反应②加成反应③消去反应④加聚反应⑤氧化反应⑥水解反应
(3)写出A的结构简式_______,C中含氧官能团名称是_______
(4)B分子中的甲基被苯基取代后的有机化合物具有许多同分异构体,写出其中一种苯环上有三个取代基的同分异构体的结构简式______________
(5)写出反应③的化学方程式_____________________
聚丙烯酸钠的结构简式______________.
31.[化学——物质结构与性质]
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+ N2H62+等。
回答以下问题:
(1)某元素原子与N3_含有相同的电子数,其基态原子的价电子排布式是_______。
(2) C、N、O三种元素第一电离能从大到小的顺序是_______。
(3)肼@2H4)分子可视为NH3分子中的一个氢原子被一NH2 (氨基)取代形成的另
一种氮的氢化物。NH3分子的空间构型是_______; N2H4分子中氮原子轨道的杂化类型是_______
(4)胼能与硫酸反应生成N2H6S04。N2H6S04晶体类型与硫酸铵相同,则N2H6S04 的晶体内不存在_______(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(5)NH3. N2H4、NH4' N2H62+四种微粒中,能形成氢键的有_______;不能作为配位体的有_______。32.[化学——有机化学基础]
丙烯可合成高吸水性聚丙烯酸钠树脂,下面是丙烯合成聚丙烯酸钠的化工流程。回答..
(1)丙烯的分子式 为
(2)丙烯不哮发生的有机反应类型有_______ (填数字序号λ
①取代反应②加成反应③消去反应④加聚反应⑤氧化反应⑥水解反应
(3)写出A的结构简式_______, C中含氧官能团名称是_______
(4)B分子中的甲基被苯基取代后的有机化合物具有许多同分异构体,写出其中一种苯 环上有三个取代基的同分异构体的结构简式______________
(5)写出反应③的化学方程式_____________________
聚丙烯酸钠的结构简式______________.
正确答案
第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
30.[化学—物质结构与性质](13分)
卟啉类化合物是生物体中色素结构的常见基本单元,其结构可用右图表示
试分析该化合物中,回答下列问题
(1)氮元素基态原子的核外电子中,未成对电子数与成对电子数之比为( ) 。(2)卟啉环(不考虑取代基-R)的主要组成元素,电负性由大到小的顺序为_________。卟啉环内C原子的杂化轨道类型为___________。
(3)化合物(CN)2的结构和性质与卤素单质相似,因此称为拟卤素。已知CN-与N2具有相同的结构和成键情况。判断(CN)2分子中σ键与π键的个数比为 ______。
(4)第四周期元素M的离子可嵌入上述卟啉环中与中心四个N原子成键。
①M原子核外的未成对电子数为4个,则M原子基态的价电子排布式为___________。
②M与碳组成的某种物质的M3C,该物质在常温下能够导电,其原因是______________________________________________。
③M元素的某种化合物的熔点为282℃,沸点315℃,易溶于有机溶剂,易水解,水解最终产物的结构如下图所示,则此化合物属于________晶体,其水解产物中M的化合价为________,M的配位数为________。
31.[化学—有机化学基础]
香豆素是重要的香料、医药中间体。某研究小组设计的合成香豆素路线如下:
提示:
(1)上述合成路线中,反应⑤的反应类型是( )。
(2)H分子中含氧官能团的名称是( ),D的核磁共振氢谱图中的吸收峰有( )个。
(3)B与Cu(OH)2悬浊液反应的化学方程式为( ) 。
(4)已知芳香族化合物I是G的同分异构体,且I中苯环上只有一个取代基。则I的结构简式可能为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
其中第29.30题为物理题,第31.32题为化学题,考生 从两道物理题。两道化学题中各任选一题作答。
31.过渡元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
1.硅钨酸在 600℃-650℃可分解生成SiO2和WO3,其结构如右图。
(1)已知钨为第六周期VI B族元素,与其同族基态原子的球形轨
道电子数最少的元素X的基态原子价电子排布式为( )
X元素的核外电子的运动状态有( )种。
(2)根据硅钨酸的结构推测,WO3的结构式为( )。
(3)硅钨酸晶体中微粒间的作用力有共价键和( ) 。
2.钪为稀土元素,称为“光明之子”,新型钪钠灯充入卤化钪用于照明,提钪工艺中常用草酸法精制,草酸钪络盐的热重数据如下表:
(4)H2O分子中O原子的( )轨道与H原子的( )轨道重叠形成H—O σ键。(填轨道名称)
(5)按草酸钪络盐失水时所克服的作用力大小不同,Sc2(C2O4)3•6H2O中的水分子可以分为( )种。
(6)温度升高到423K时,Sc2(C2O4)3•6H2O转化为( ) 。(填化学式)
32.以对甲酚(A)为起始原料,通过一系列反应合成有机物E的合成路线如下:
(1)C的分子式为( ) ,A的核磁共振氢谱图中有( ) 个峰。
(2)A→B的反应类型为( )。
(3)写出D与足量NaOH的水溶液反应的化学方程式:( )。
(4)写出同时满足下列条件的D的同分异构体的结构简式:( ) 、( ) (任写两种)。
①属苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种;
②能与Na2CO3溶液反应放出气体。
(5)已知:R-CN R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式:( )。
31.过渡元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
正确答案
2.钪为稀土元素,称为“光明之子”,新型钪钠灯充入卤化钪用于照明,提钪工艺中常用草酸法精制,草酸钪络盐的热重数据如下表:
(4)H2O分子中O原子的( )轨道与H原子的( )轨道重叠形成H—O σ键。(填轨道名称)
(5)按草酸钪络盐失水时所克服的作用力大小不同,Sc2(C2O4)3•6H2O中的水分子可以分为( )种。
(6)温度升高到423K时,Sc2(C2O4)3•6H2O转化为( ) 。(填化学式)32.以对甲酚(A)为起始原料,通过一系列反应合成有机物E的合成路线如下:
(1)C的分子式为( ) ,A的核磁共振氢谱图中有( ) 个峰。
(2)A→B的反应类型为( )。
(3)写出D与足量NaOH的水溶液反应的化学方程式:( )。
(4)写出同时满足下列条件的D的同分异构体的结构简式:( ) 、( ) (任写两种)。
①属苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种;
②能与Na2CO3溶液反应放出气体。
(5)已知:R-CN R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式:( )。
第29.30题为物理题,第31.32为化学题,考生从两道物理题.两道化学题中各任选一题作答。
31.[选考:物质结构与性质]原子序数依次增大的四种主族元素A.B.C.D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。
请回答下列问题:
(1)这四种元素中电负性最大的是( )(填元素符号).第一电离能最小的是
(填元素符号);
(2)C所在的主族元素气态氢化物中,沸点最低的是( ) (填化学式);
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄.最坚硬.传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原
子的杂化类型为 ( );
(4)D的水合醋酸盐晶体局部结构如图,该晶体中含有的化学键是( ) (填选项序号);
①极性键 ② 非极性键
③ 配位键 ④ 金属键
(5)某学生所做的有关D元素的实验流程如下图:
请书写第⑤反应的离子方程式:( ) 。
32.[选考:有机化学基础] PET是产量最大的合成纤维,它的化学式是
(1)PET的名称是 ( ) 。
(2)PET在酸溶液中水解生成两种烃的含氧衍生物PTA和EG(PTA.分子量大于EG),PTA的结构简式是( ) ;PTA有多种同分异构体,含三个官能团且官能团均处间位的芳香族同分异构体共有 种,其中一种的结构简式是 ( ) 。
(3)PET的水解产物EG是重要的有机化工原料。EG和有机物甲.乙.丙间存在如下的转化关系(无机反应物.生成物均已略去):
甲乙丙分子内均只含一种官能团。乙+EG→丙反应类型是( ) ;甲乙丙中的一种可以发生银镜反应,写出它与足量银氨溶液反应的化学方程式:( )。
31.[选考:物质结构与性质]原子序数依次增大的四种主族元素A.B.C.D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。
请回答下列问题:
(1)这四种元素中电负性最大的是 (填元素符号).第一电离能最小的是
(填元素符号);
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式);
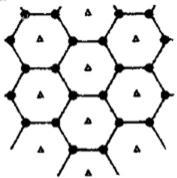
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄.最坚硬.传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原
子的杂化类型为 ;
(4)D的水合醋酸盐晶体局部结构如图,该晶体中含有的化学键是 (填选项序号);
① 极性键 ② 非极性键
③ 配位键 ④ 金属键
(5)某学生所做的有关D元素的实验流程如下图:
请书写第⑤反应的离子方程式: 。
(1)PET的名称是 。
(2)PET在酸溶液中水解生成两种烃的含氧衍生物PTA和EG(PTA.分子量大于EG),PTA的结构简式是 ;PTA有多种同分异构体,含三个官能团且官能团均处间位的芳香族同分异构体共有 种,其中一种的结构简式是 。
(3)PET的水解产物EG是重要的有机化工原料。EG和有机物甲.乙.丙间存在如下的转化关系(无机反应物.生成物均已略去):

甲乙丙分子内均只含一种官能团。乙+EG→丙反应类型是 ;甲乙丙中的一种可以发生银镜反应,写出它与足量银氨溶液反应的化学方程式:
。
正确答案
36.请从36-38题中任选一题作答。
36.[化学——选修化学与技术]
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)电镀时,用镀层金属作阳极的作用是( ).为了使镀层厚度均匀、光滑致密、与镀件的附着力强,除控制溶液中离子浓度外,通常还可以采取的措施有( )
(2)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是( ),目的是( )。
上述提取镁的流程中,为了降低成本.减少污染,可以采取很多措施,请写出其中一点
③有同学认为:步骤b后可加热Mg(0H)2得到Mg0,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(3)铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中( )的U4+,而不吸附其他元素。其反应原理为( )树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理 为( )。
(4)阿司匹林(
37.[化学——选修3:物质结构与性质]
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1 817、2 745、ll 575;E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q。
(1)写出A的基态核外电子排布式( );用最简式表示B、C形成合金的组成( )(用B、C元素符号表示)。该合金的密度为 a g/cm3,其晶胞的边长为( )。
(2)C2+和A2+都能与NH3、H20等形成配位数为4的配合物。[A(NH3)4]2+和[C(NH3)4]2+空间构型不同且都具有对称性,则[C(NH3)4]2+的空间构型为( )。[A(NH3)4]2+中A原子轨道的杂化方式为( )。
(3) 含有D、碳、硫三种元素的负一价离子中,所有原子均满足最外层8电子结构,一个电子是由硫原子所得,则其电子式为( )。
(4)实验测得气态无水Q在1.Ol×105 Pa、t1℃的密度为5.OO g·L-1、气体摩尔体积为53.4 L·mol-,则此时Q的组成为(写化学式)( ),
38. [化学——选修5:有机化学基础]
A是一种药用有机物,在生活中有较高的用途.A的转化关系如下图所示。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基处于邻位,D能跟NaOH溶液反应。
请回答:
(1)A转化为B、C时.涉及到的反应类有( )、( )。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q( )、R( )。
(3)D的结构简式为( )。
(4)写出A在加热条件下与NaOH溶液反应的化学方程式( )。
(5)已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
31.其中第29.30题为物理题,第31.32题为化学题,考生 从两道物理题.两道化学题中各任选一题作答。
[化学——物质结构与性质]
不锈钢的种类很多,其中一种铁元素以外,还含有较多的Cr(铬).Ni(镍).Mo(钼),少量 的Si(硅).C(碳),微量的S(硫).P(磷)。
(1)上述元素中属于第三周期且第一电离能从大到小排列的是_______
(2)Mo(钼)处于第五周期,且与Cr(铬)元素位于同一族,则基态Mo(钼)原子的外围电 子(价电子)排布式是_______。
(3)CH4的沸点比SiH4低,原因是_______o
(4)镍元素能形成多种配合物,配离子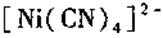
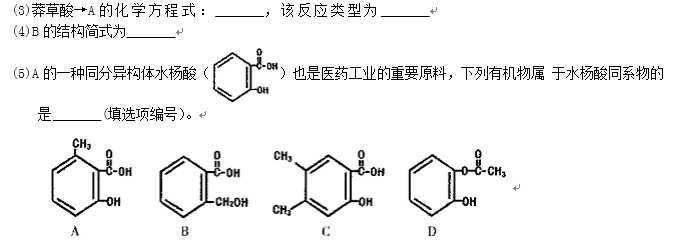
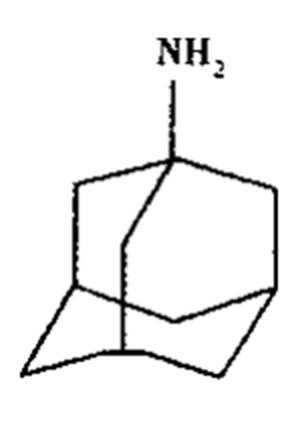
金刚焼胺和达菲都是防治人传染禽流感的常有药。金刚烷胺结构式:
(1)金刚烷胺的分子式为_______。
(2)金刚烷胺的同分异构体中____(填“存在”或“不存在”)
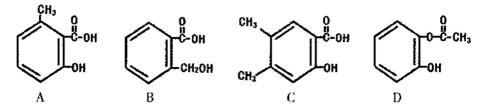
芳香族化合物。
生产达菲的主要原料是莽草酸,莽草酸存在以下转化关系:
正确答案
正确答案
24.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。
请回答下列问题(填空时用实际符号):
(1) C的元素符号是( );元素F在周期表中的位置( )。
(2) B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为( ),其固体时的晶体类型是( )。
(3) 最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示,已知断裂lmolC-C吸收167kJ热量,生成Imo1C=C放出942kJ热量。根据以上信息和数据,下列说法正确的是( )。
① C4属于一种新型的化合物
② C4沸点比P4(白磷)低
③ lmol C4气体转变为C2吸收882kJ热量
④ C4与C4互为同素异形体
⑤ C4稳定性比P4(白磷)差
⑥ C4属于原子晶体
⑦ C4和P4 (白磷)的晶体都属于分子晶体
⑧ C4与C2互为同分异构体
(4) C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为( ),其空间构型为( )。
(5)为了除去化合物乙(A2ED4);)稀溶液中混有的A2ED4,常采用A2D2为氧化剂,发生反应的离子方程式为:( )
(6) E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是( )。
a .E2F2的结构式为:F- E—E- F
b.E2F2为含有极性键 和非极性键的非极性分子
c. E2Br2与E2F2结构相似,熔沸点:E2Br2> E2F2
d. E2F2与H2O反应的化学方程式可能为:2 E2F2+2H2O=EO2↑+ 3E↓+4HF
(7) 举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析