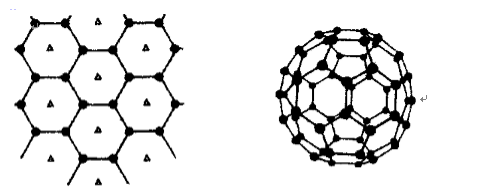
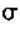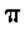- 原子核外电子排布
- 共93题
其中第28、29题为物理题,第30、31题为化学题。考生从两道物理、两道化学题中各任选一题作答。
30.(选考——物质结构与性质)
X、Y、Z、Q为短周期非金属元素, R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为( ) 。
(2) X、Y、Z三种元素第一电离能从大到小顺序为( )。
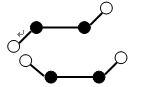
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是( )
A. 仅1个σ键
B. 1个σ键和2个π键
C. 1个σ键和1个π键
D. 仅2个σ键
②该分子中Y原子的杂化方式是( )
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式
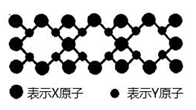
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 ( )
A. 该晶体属于分子晶体
B. 此晶体的硬度比金刚石还大
C. 晶体的化学式是X3Y4
D. 晶体熔化时共价键被破坏,没有克服范德华力和氢键
31.(选考——有机化学基础)
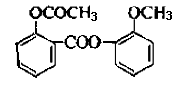
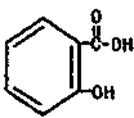
醋柳酯是一种镇咳祛痰药。用于上呼吸道感染、感冒咳嗽、急慢性支气管炎症等的治疗,其结构简式如右。回答下列问题:
(1)醋柳酯的分子式为 ( )。
(2)关于醋柳酯说法正确的是为( )
A.是高分子化合物
B.可与氢气发生加成反应
C.不能发生银镜反应
D.能发生水解反应且只生成2种有机物
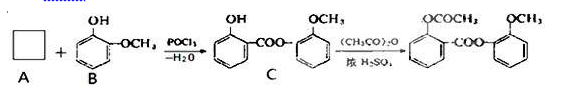
(3)醋柳酯可由下图所示路线合成
①中间产品C中混有反应物A和B,检验C中含有A的反应可以是(用化学反应方程式表示)
②写出C和足量NaOH溶液反应的化学方程式( )。
③A的同分异构体很多,写出属于酯类,且能与FeCl3反应显紫色的同分异构体的结构简式是( )。
30. (选考——物质结构与性质)
X、Y、Z、Q为短周期非金属元素, R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为 。
(2) X、Y、Z三种元素第一电离能从大到小顺序为 。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):

正确答案
第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
30.【化学——物质结构与性质】
金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(1)请解释金属铜能导电的原因
Cu2+的核外电子排布式为__________________________。
(2)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
①胆矾中含有的化学键有 ( )(填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
②有关胆矾说法正确的是( )
A.结晶水中的氧原子采用SP2杂化; B.硫酸根离子为正四面体形;
C.胆矾中的水在不同温度下会分步失去;
③胆矾受热分解得到铜的某种氧化物,其晶胞结构如图所示,则该氧化物的化学式 ( )。
(3)已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个 Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+ 的空间构型为( ) 。
31.【化学——有机化学基础】
已知:一个碳原子上连多个羟基时不稳定,
烃A含有碳碳叁键,且有如图的转化关系:
(1)写出物质C的结构简式:_____________________,指出反应⑥的反应类型:____________。
(2)D中含氧官能团的名称为_____________________________。
(3)写出C与银氨溶液反应的化学反应方程式: ______________________________________
(4)与G具有相同官能团的同分异构体有四种,其中两种为:
请写出其他两种( )、( )。
30.【化学——物质结构与性质】
金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(1)请解释金属铜能导电的原因
正确答案
第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
30.[化学—物质结构与性质](13分)
卟啉类化合物是生物体中色素结构的常见基本单元,其结构可用右图表示
试分析该化合物中,回答下列问题
(1)氮元素基态原子的核外电子中,未成对电子数与成对电子数之比为( ) 。(2)卟啉环(不考虑取代基-R)的主要组成元素,电负性由大到小的顺序为_________。卟啉环内C原子的杂化轨道类型为___________。
(3)化合物(CN)2的结构和性质与卤素单质相似,因此称为拟卤素。已知CN-与N2具有相同的结构和成键情况。判断(CN)2分子中σ键与π键的个数比为 ______。
(4)第四周期元素M的离子可嵌入上述卟啉环中与中心四个N原子成键。
①M原子核外的未成对电子数为4个,则M原子基态的价电子排布式为___________。
②M与碳组成的某种物质的M3C,该物质在常温下能够导电,其原因是______________________________________________。
③M元素的某种化合物的熔点为282℃,沸点315℃,易溶于有机溶剂,易水解,水解最终产物的结构如下图所示,则此化合物属于________晶体,其水解产物中M的化合价为________,M的配位数为________。
31.[化学—有机化学基础]
香豆素是重要的香料、医药中间体。某研究小组设计的合成香豆素路线如下:
提示:
(1)上述合成路线中,反应⑤的反应类型是( )。
(2)H分子中含氧官能团的名称是( ),D的核磁共振氢谱图中的吸收峰有( )个。
(3)B与Cu(OH)2悬浊液反应的化学方程式为( ) 。
(4)已知芳香族化合物I是G的同分异构体,且I中苯环上只有一个取代基。则I的结构简式可能为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
其中第29.30题为物理题,第31.32题为化学题,考生 从两道物理题。两道化学题中各任选一题作答。
31.过渡元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
1.硅钨酸在 600℃-650℃可分解生成SiO2和WO3,其结构如右图。
(1)已知钨为第六周期VI B族元素,与其同族基态原子的球形轨
道电子数最少的元素X的基态原子价电子排布式为( )
X元素的核外电子的运动状态有( )种。
(2)根据硅钨酸的结构推测,WO3的结构式为( )。
(3)硅钨酸晶体中微粒间的作用力有共价键和( ) 。
2.钪为稀土元素,称为“光明之子”,新型钪钠灯充入卤化钪用于照明,提钪工艺中常用草酸法精制,草酸钪络盐的热重数据如下表:
(4)H2O分子中O原子的( )轨道与H原子的( )轨道重叠形成H—O σ键。(填轨道名称)
(5)按草酸钪络盐失水时所克服的作用力大小不同,Sc2(C2O4)3•6H2O中的水分子可以分为( )种。
(6)温度升高到423K时,Sc2(C2O4)3•6H2O转化为( ) 。(填化学式)
32.以对甲酚(A)为起始原料,通过一系列反应合成有机物E的合成路线如下:
(1)C的分子式为( ) ,A的核磁共振氢谱图中有( ) 个峰。
(2)A→B的反应类型为( )。
(3)写出D与足量NaOH的水溶液反应的化学方程式:( )。
(4)写出同时满足下列条件的D的同分异构体的结构简式:( ) 、( ) (任写两种)。
①属苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种;
②能与Na2CO3溶液反应放出气体。
(5)已知:R-CN R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式:( )。
31.过渡元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
正确答案
2.钪为稀土元素,称为“光明之子”,新型钪钠灯充入卤化钪用于照明,提钪工艺中常用草酸法精制,草酸钪络盐的热重数据如下表:
(4)H2O分子中O原子的( )轨道与H原子的( )轨道重叠形成H—O σ键。(填轨道名称)
(5)按草酸钪络盐失水时所克服的作用力大小不同,Sc2(C2O4)3•6H2O中的水分子可以分为( )种。
(6)温度升高到423K时,Sc2(C2O4)3•6H2O转化为( ) 。(填化学式)32.以对甲酚(A)为起始原料,通过一系列反应合成有机物E的合成路线如下:
(1)C的分子式为( ) ,A的核磁共振氢谱图中有( ) 个峰。
(2)A→B的反应类型为( )。
(3)写出D与足量NaOH的水溶液反应的化学方程式:( )。
(4)写出同时满足下列条件的D的同分异构体的结构简式:( ) 、( ) (任写两种)。
①属苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种;
②能与Na2CO3溶液反应放出气体。
(5)已知:R-CN R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3)。写出F的结构简式:( )。
31.其中第29.30题为物理题,第31.32题为化学题,考生 从两道物理题.两道化学题中各任选一题作答。
[化学——物质结构与性质]
不锈钢的种类很多,其中一种铁元素以外,还含有较多的Cr(铬).Ni(镍).Mo(钼),少量 的Si(硅).C(碳),微量的S(硫).P(磷)。
(1)上述元素中属于第三周期且第一电离能从大到小排列的是_______
(2)Mo(钼)处于第五周期,且与Cr(铬)元素位于同一族,则基态Mo(钼)原子的外围电 子(价电子)排布式是_______。
(3)CH4的沸点比SiH4低,原因是_______o
(4)镍元素能形成多种配合物,配离子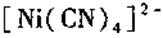
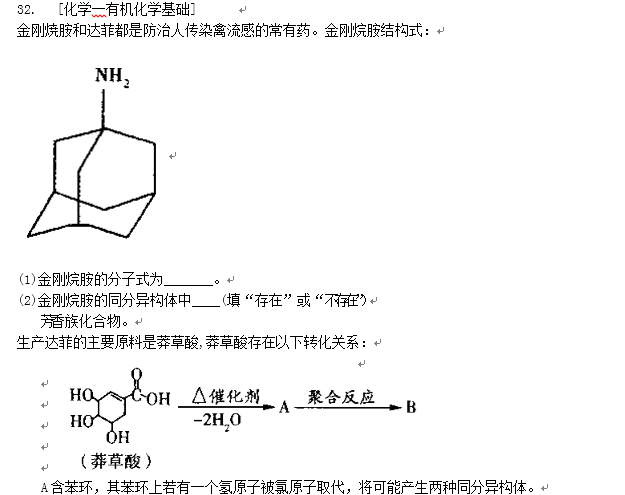
金刚焼胺和达菲都是防治人传染禽流感的常有药。金刚烷胺结构式:
(1)金刚烷胺的分子式为_______。
(2)金刚烷胺的同分异构体中____(填“存在”或“不存在”)
芳香族化合物。
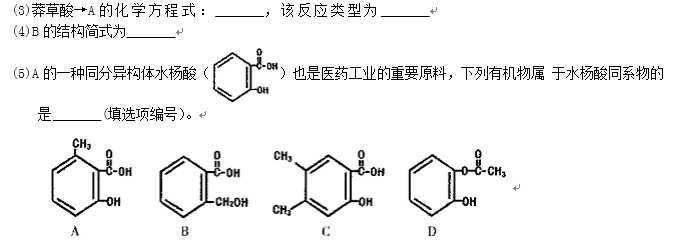
生产达菲的主要原料是莽草酸,莽草酸存在以下转化关系:
正确答案
正确答案
扫码查看完整答案与解析