- 常见气体的制备与收集
- 共133题
氰化物多数易溶于水,有剧毒,易造成水污染。为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究一:测定含氰水样中处理百分率为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验。将CN-的浓度为0.2000 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
15.①和⑥的作用是 ;
16.反应结束后,缓缓通入空气的目的是 ;
17.为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置 反应前后的质量(从装置①到⑥中选择,填装置序号)。
探究二:探究氰化物的性质已知部分弱酸的电离平衡常数如下表:
18.NaCN溶液呈碱性的原因是 (用离子方程式表示)
19.下列选项错误的是__________A.2CN-+H2O+CO2=2HCN+CO32-B.2HCOO
20.H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为 。
21.处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-) c(HCN)(填“>”、“<”或“=”)
正确答案
吸收空气中的CO2
解析
实验过程中,进入装置的空气必须不含二氧化碳,否则会是装置⑤中吸收到的二氧化碳质量偏大,进而影响实验结果,所以为了避免空气中的二氧化碳进入实验装置,增设了装置①和⑥ 。
考查方向
解题思路
考查实验设计与评价能力,装置②中发生反应:CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ + 3C1O-=N2↑+2CO2↑+ 3C1-+H2O利用对产生的二氧化碳的质量的测定达到计算含氰废水被处理的百分率的实验目的。在实验过程中需要考虑空气中的二氧化碳的干扰以及装置中残留二氧化碳对实验结果的影响。
易错点
本题在弱电解质的电离平衡和水解平衡的理解上容易出现错误。
正确答案
使生成的气体全部进入到装置⑤中(或Ba(OH)2 )
解析
反应结束后,实验装置中残留二氧化碳气体,这部分气体没有被装置⑤中的氢氧化钡溶液吸收,从而使的实验测定数据偏低,所以反应结束后,缓缓痛如空气的目的是使生成的气体全部进入到装置⑤中。
考查方向
解题思路
本题第一部分考查实验设计与评价能力,装置②中发生反应:CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ + 3C1O-=N2↑+2CO2↑+ 3C1-+H2O利用对产生的二氧化碳的质量的测定达到计算含氰废水被处理的百分率的实验目的。在实验过程中需要考虑空气中的二氧化碳的干扰以及装置中残留二氧化碳对实验结果的影响。
易错点
本题在弱电解质的电离平衡和水解平衡的理解上容易出现错误。
正确答案
⑤
解析
(3)利用对产生的二氧化碳的质量的测定达到计算含氰废水被处理的百分率的实验目的,所以需要测定的是装置⑤中反映前后的质量。
考查方向
本题主要考查了实验设计与评价能力及弱电解质的电离平衡和水解平衡。
解题思路
考查氰化物在水溶液中的水解平衡以及相关离子方程式的书写问题。
易错点
本题在弱电解质的电离平衡和水解平衡的理解上容易出现错误。
正确答案
CN-+H2O
解析
NaCN溶液呈碱性的原因是由于CN-发生了水解反应:CN-+H2O
考查方向
解题思路
考查氰化物在水溶液中的水解平衡以及相关离子方程式的书写问题。
易错点
本题在弱电解质的电离平衡和水解平衡的理解上容易出现错误。
正确答案
AC
解析
产物CO32-不能稳定存在,会继续和HCN反应生成HCO3- ,A选项错误;HCOOH的电离度大于HCN,等pH的HCOOH和HCN溶液,HCN浓度较大,故中和等体积、等浓度的NaOH消耗等pH的HCOOH和HCN溶液的体积前者大于后者。
考查方向
解题思路
考查氰化物在水溶液中的水解平衡以及相关离子方程式的书写问题。
易错点
本题在弱电解质的电离平衡和水解平衡的理解上容易出现错误。
正确答案
KHCO3
解析
根据质量守恒定律可知生成物A的化学式为KHCO3。
考查方向
解题思路
考查氰化物在水溶液中的水解平衡以及相关离子方程式的书写问题。
易错点
本题在弱电解质的电离平衡和水解平衡的理解上容易出现错误。
正确答案
<
解析
含CN-的废水中存在CN-+H2O 
Kh=Kw÷Ka=(1×10-14)÷(5.0×10-10)=[c(CN-)×10-9]÷c(CN-)
解得c(HCN)÷c(CN-)=2×104,所以此时c(CN-)
考查方向
解题思路
考查氰化物在水溶液中的水解平衡以及相关离子方程式的书写问题。
易错点
本题在弱电解质的电离平衡和水解平衡的理解上容易出现错误。
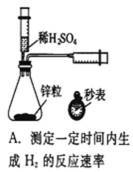
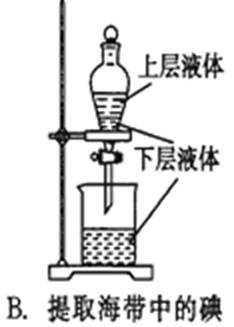
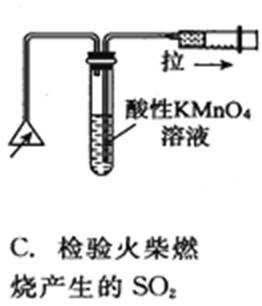
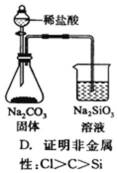
4.列实验装置正确且能完成实验目的的是()
正确答案
解析
A.测定生成氢气的反应速率需要测定时间和收集气体体积,有测定体积的仪器和测定时间的仪器,所以可以实现实验目的,故A正确;
B.海带中碘以离子的形式存在,应先发生氧化还原反应后生成碘单质,再萃取、分液,故B错误;
C.二氧化硫具有还原性,能使高锰酸钾溶液褪色,图中试管中的导管长短应互换,故C错误;
D.盐酸具有挥发性,生成的二氧化碳中含有氯化氢,HCl也能和碳酸钠反应生成硅酸沉淀,所以干扰实验,且HCl不是氯元素的最高价氧化物是水化物,所以不能实现实验目的,故D错误。
考查方向
解题思路
A.测定生成氢气的反应速率需要测定时间和收集气体体积;
B.海带中碘以离子的形式存在;
C.二氧化硫具有还原性,能使高锰酸钾溶液褪色;
D.生成的二氧化碳中含有HCl而干扰实验,元素的非金属性越强其最高价氧化物的水化物酸性越强
易错点
本题考查化学实验方案评价,为高考高频点,明确实验原理是解本题关键,涉及非金属性的比较、氧化还原、碘的提纯等,注意实验原理和实验细节的考查,题目难度中等。
知识点
18.下列
正确答案
解析
A.氯水中的次氯酸能漂白pH试纸,不能用pH试纸测定新制氯水的pH值,故A错误;
B.液体加热要加沸石或碎瓷片,引入汽化中心,可防止溶液暴沸,如果加热一段时间后发现忘记加碎瓷片,应该采取停止加热,待溶液冷却后重新添加碎瓷片,故B正确;
C.硫酸钡和AgCl均为不溶于酸的白色沉淀,则向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失,溶液中可能含Ag+,故C错误;
D.氯化钠中混有少量的硝酸钾,氯化钠是大量的,制得的饱和溶液中硝酸钾量较少,不能采取降温结晶的方法,故D错误
考查方向
化学实验方案的评价
解题思路
A.氯水中的次氯酸能漂白pH试纸;
B.液体加热要加沸石或碎瓷片,防止暴沸,如果加热一段时间后发现忘记加碎瓷片,应该采取停止加热,待溶液冷却后重新添加碎瓷片;
C.硫酸钡和AgCl均为不溶于酸的白色沉淀;
D.氯化钠中混有少量的硝酸钾,不能制得硝酸钾的饱和溶液
易错点
D项中,若硝酸钾中混有少量的氯化钠,可以采用此方法提纯
教师点评
本题考查化学实验方案的评价,涉及实验室中常见操作和物质的提纯与检验,难度不大
知识点
4.下列实验中,所采取的操作方法、对应现象和结论均正确的是
正确答案
解析
A.乙醇、乙烯和二氧化硫都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,则乙醇和二氧化硫都干扰乙烯的检验,应该用水溶液除去乙醇、用氢氧化钠溶液除去二氧化硫,然后将气体通入酸性高锰酸钾或溴水中检验乙烯,故A错误;
B.葡萄糖的银镜反应需要在碱性条件下进行,所以在加入银氨溶液之前必须加入NaOH中和未反应的稀硫酸,否则实验不成功,故B错误;
C.氯气和水反应生成HCl、HClO,氯气和水生成的HCl能和硝酸银溶液反应生成白色沉淀,所以有白色沉淀生成不能说明发生了取代反应,故C错误;
D.酸的酸性越强,相同浓度的钠盐溶液的pH越小,用pH计测定0.1mol•L-1的碳酸氢钠和醋酸钠的pH值,碳酸氢钠溶液的pH大于醋酸钠,则说明醋酸酸性强于碳酸,故D正确
考查方向
化学实验方案评价
解题思路
A.乙醇、乙烯和二氧化硫都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
B.葡萄糖的银镜反应需要在碱性条件下进行;
C.氯气也能和硝酸银溶液反应生成白色沉淀;
D.酸的酸性越强,相同浓度的钠盐溶液的pH越小
易错点
B项:葡萄糖的银镜反应需要在碱性条件下进行
教师点评
本题考查化学实验方案评价,涉及酸性强弱判断、氯气的性质、物质检验、除杂等知识点,明确实验原理、物质性质及物质性质差异性是解本题关键,侧重考查学生分析判断及思维缜密性
知识点
某实验小组用下图装置制备家用消毒液,并探究其性质。
反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
29.写出利用上述装置制备消毒液涉及反应的化学方程式 、 。
30.查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有 性。
31.该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
① 操作b中溶液变成黄绿色的原因: (用离子方程式表示)。
② 有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是 。
32.有效氯的含量是检测含氯消毒剂消毒效果的重要指标。具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上。小组同学进行如下实验测定有效氯:
取此消毒液5 g,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液;加几滴淀粉溶液后,用0.1 mol·L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3 20 mL。(已知:2S2O32- + I2 === S4O62- + 2I-)
① 达到滴定终点时的实验现象是 。
② 此消毒液有效氯含量为 %(保留一位有效数字)。
获得结论:此实验制得的消毒液 (填“符合”或“不符合”)家用要求。
正确答案
4HCl + MnO2 === Cl2↑ + MnCl2 + 2H2O、Cl2 + 2NaOH === NaClO + NaCl + H2O
解析
该装置中发生的反应有两个,一个是制取氯气,反应的方程式为4HCl + MnO2 === Cl2↑ + MnCl2 + 2H2O,另一个是氯气与氢氧化钠发生反应制取消毒液,发生反应的方程式为Cl2 + 2NaOH === NaClO + NaCl + H2O,故答案为4HCl + MnO2 === Cl2↑ + MnCl2 + 2H2O、Cl2 + 2NaOH === NaClO + NaCl + H2O;
考查方向
解题思路
本题把氯气的实验室制法、氯气的化学性质、氯气的工业制法综合一起,考查了学生综合运用知识解决问题的能力,能训练学生的审题能力、思维能力和规范答题的能力。
(1)根据实验室制取氯气的反应原理思考;
(2)根据除杂方法和制取消毒液的原理分析;
(3)根据氯气的化学性质分析;
易错点
1、中和滴定的计算。
2、根据实验室制取氯气的反应原理思考化学实验的设计和评价实验探究。
正确答案
5mL pH = 13 漂白性
解析
根据资料可知,酚酞在强碱性溶液中红色会褪去,则为了验证溶液褪色的原因,需要补充碱性溶液使酚酞褪色的对比实验,在这一过程中要注意物质的体积与浓度原溶液相同,所以应取5mL,PH=13的NaOH溶液;通过对比实验的现象,溶液在30min后褪色,与原实验对比5min后褪色证明溶液褪色原因为消毒液的漂白性,故答案为5mL pH = 13,漂白性;
考查方向
解题思路
本题把氯气的实验室制法、氯气的化学性质、氯气的工业制法综合一起,考查了学生综合运用知识解决问题的能力,能训练学生的审题能力、思维能力和规范答题的能力。
(1)根据实验室制取氯气的反应原理思考;
(2)根据除杂方法和制取消毒液的原理分析;
(3)根据氯气的化学性质分析;
易错点
1、中和滴定的计算。
2、根据实验室制取氯气的反应原理思考化学实验的设计和评价实验探究。
正确答案
① 2H+ + ClO- + Cl- === Cl2↑+ H2O
② 取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色
解析
①溶液变成黄绿色的原因为ClO- 与 Cl-在酸性条件下发生氧化还原反应生成了氯气,反应的方程式为2H+ + ClO- + Cl- === Cl2↑+ H2O;故答案为2H+ + ClO- + Cl- === Cl2↑+ H2O;
②操作b中加入的酸为盐酸,盐酸中含有参与反应的Cl-,所以不严谨,所以补充的实验为将盐酸换成硫酸即可,故答案为取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色;
考查方向
本题主要考查了化学实验的设计和评价实验探究、氯及其化合物。
解题思路
本题把氯气的实验室制法、氯气的化学性质、氯气的工业制法综合一起,考查了学生综合运用知识解决问题的能力,能训练学生的审题能力、思维能力和规范答题的能力。
(1)根据实验室制取氯气的反应原理思考;
(2)根据除杂方法和制取消毒液的原理分析;
(3)根据氯气的化学性质分析;
易错点
1、中和滴定的计算。
2、根据实验室制取氯气的反应原理思考化学实验的设计和评价实验探究。
正确答案
① 溶液蓝色褪去
② 1.42 %
解析
①用Na2S2O3溶液滴定生成的I2,而这反应的方程式为2S2O32- + I2 === S4O62- + 2I-,则滴定终点的现象为溶液蓝色褪去,故答案为溶液蓝色褪去;②n(Na2S2O3)=20*10-3*0.1=2*10-3mol,2S2O32- + I2 === S4O62- + 2I-,则n(I2)=1/2n(Na2S2O3)=10*-3,消毒液在酸性条件下与KI反应的离子方程式为4H++2ClO-+2I-=Cl2+I2+2H2O,则n(Cl2)= n(I2)=10*-3,则有效氯含量为71*10*-3/5=1.42 %<5%,则该消毒液不符合家用要求,故答案为1.42 %,不符合。
考查方向
解题思路
本题把氯气的实验室制法、氯气的化学性质、氯气的工业制法综合一起,考查了学生综合运用知识解决问题的能力,能训练学生的审题能力、思维能力和规范答题的能力。
(1)根据实验室制取氯气的反应原理思考;
(2)根据除杂方法和制取消毒液的原理分析;
(3)根据氯气的化学性质分析;
易错点
1、中和滴定的计算。
2、根据实验室制取氯气的反应原理思考化学实验的设计和评价实验探究。
侯德榜是我国著名科学家,1933年出版《纯碱制造》一书,创立了中国自己的制碱
工艺。其纯碱制造原理如下图所示:
21.由NaHCO3制备纯碱的化学方程式是 。
22.过程Ⅰ通入NH3和CO2的顺序是 。
23.过程Ⅱ析出NH4Cl(s)的原因是 。
24.充分利用副产品NH4Cl生产NH3和HCl。直接加热分解NH4Cl,NH3和HCl的产率
往往很低,原因是 。
25.采用MgO循环分解NH4Cl。加热,在300℃以下获得NH3;继续加热至350℃~600℃获得HCl气体。利用下列装置(加热及加持装置略)可测量NH3和HCl的产率。
① 低于300℃时,干燥管盛装的干燥剂是 。NH3吸收完全后,更换干燥剂和吸收装置中的吸收液。
② 产生NH3的化学反应方程式是 。
③ 在350℃~60
④ MgO可以循环分解NH4Cl制得NH3和HCl的原因是 (结合化学方
程式解释)。
正确答案
(1)2NaHCO3

解析
纯碱即碳酸钠,侯氏制碱法先是制得碳酸氢钠,利用碳酸氢钠的不稳定性,将其受热得到碳酸钠。
考查方向
考查了高中化学常见化学方程式的书写
解题思路
根据碳酸氢钠与碳酸钠的化学性质,联系课本所学,直接写书
易错点
题目简单,书写时注意化学式与配平
教师点评
本小问简单,考查了高中化学常见化学反应方程式的书写,学习中注意掌握。
正确答案
(2)先通NH3,后通CO2 (2 分)
正确答案
(3)NH4Cl(s) 
正确答案
(4)NH3 + HCl = NH4Cl (2 分)
正确答案
(5)① 碱石灰 (1分)
② MgO + 2NH4Cl 
③ c (1 分)


MgCl2+2H2O Mg(OH)2+2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2 MgO+H2O,
所以MgO可以循环应用与NH4Cl反应制得NH3和HCl。 (2 分)
10.下列装置或操作能达到实验目的的是( )
正确答案
解析
①.从碘水中分离碘单质,可以采取先萃取后蒸馏的方法,①错误;
②.用铜和稀硝酸反应制取一氧化氮气体,用排水法收集,②错误;
③.证明铁生锈时与氧气反应时,U形管两侧液面高度不一,③正确;
④.检查装置的气密性时,若气密性好,乙管液面比甲管高,④正确。
故选C。
考查方向
解题思路
①.从碘水中分离碘单质,可以采取先萃取后蒸馏的方法;
②.用铜和稀硝酸反应制取一氧化氮气体,用排水法收集;
③.证明铁生锈时与氧气反应时,U形管两侧液面高度不一;
④.检查装置的气密性时,若气密性好,乙管液面比甲管高。
易错点
本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯及实验基本操作等,把握物质的性质、实验技能为解答的关键,侧重性质与实验的考查,注意实验的可行性、评价性分析,题目难度不大。
知识点
用下图装置(夹持.加热装置已略)进行试验,有②中现象,不能证实①中反应发生的是
正确答案
解析
略
知识点
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体可能是
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
正确答案
解析
略
知识点
将装满气体X的试管倒置于装有液体Y的水槽中,下列说法合理的是
正确答案
解析
略
知识点
扫码查看完整答案与解析