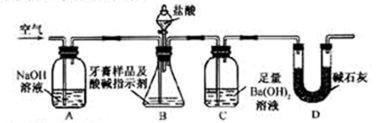- 常见气体的制备与收集
- 共133题
15.下列气体的制备和性质实验中,由现象得出的结论错误的是
正确答案
解析
A,NH3制备可以采取浓氨水和生石灰制取,可用红色石蕊试纸检验,试纸变蓝则说明NH3为碱性气体,正确;B,利用浓硫酸的高沸点性,可以制取HCl气体,pH试纸变红,则说明气体为酸性气体,正确;C,浓盐酸和二氧化锰加热可以制取Cl2,Cl2可以用湿润的淀粉碘化钾试纸检验,试纸变蓝,说明KI转化为I2,则说明Cl2有强氧化性,正确;D,SO2使品红溶液褪色体现的是SO2的漂白性,错误。故选D。
考查方向
解题思路
SO2使品红试液褪色是其漂白性。
易错点
SO2的漂白性与还原性混淆。
知识点
11.下列说法正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
(1)摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水成分搅拌、过滤。
1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_______。
2)往1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_______。
(2)牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________。
4)C中反应生成BaCO3的化学方程式是___________。
5)下列各项措施中,不能提高测定准确度的是_____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A—B之间增添盛有浓硫酸的洗气装置
d. 在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。则样品中碳酸钙的质量分数为_________。
7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是__________。
正确答案
见解析。
解析
1)氢氧化铝与NaOH溶液反应的离子方程式书写,要求基础。
Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2-+2H2O
2)生成的是NaAlO2溶液,通入CO2气体有Al(OH)3白色沉淀生成,并且生成NaHCO3,加入盐酸有CO2气体产生、Al(OH)3沉淀溶解。学生完整描述实验现象要比较扎实的基本功。
3)实验过程中需持续缓缓通入空气,把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收。这样设问学生经常接触。
4)CO2+Ba(OH)2=BaCO3↓+H2O,基础简单的方程式书写。
5)在加入盐酸之前,应排净装置内的CO2气体,会影响测量,滴加盐酸不宜过快,保证生成的CO2完全被吸收。在A—B之间增添盛有浓硫酸的洗气装置,因为整个装置中不需要干燥,有水份不会影响CO2吸收。在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置,C瓶中是足量Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2吸收,所以不需要除去CO2中的HCl,选cd。
6)BaCO3质量为3.94g ,n(BaCO3)=0.0200mol, 则n(CaCO3)=0.0200mol,质量为2.00g,则样品中碳酸钙的质量分数为25%。此问计算比较简单。
7)Ba(OH)2溶液还吸收了水蒸气、氯化氢气体等,造成质量偏大,所以可以回答B中的水蒸气、氯化氢气体等进入装置C中。
知识点
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅 用此装置和表中提供的物质完成相关实验,最合理的选项是
正确答案
解析
略
知识点
实验室进行下列实验,在选择实验装置时应当考虑冷凝回流装置的是()
正确答案
解析
略
知识点
下列实验能达到相应目的的是( )。
正确答案
解析
略
知识点
28.某化学课外活动小组在实验室设计了如下图所示的实验装置,进行“氨的催化氧化”实验。
(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取:
①硝酸铵; ②碳酸铵; ③碳酸氢铵; ④氯化铵; ⑤熟石灰; ⑥氢氧化钠。
若A中制取气体时只用了一种药品,则该药品可以是_______________(填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为____________________(选填下列仪器编号,固定装置省略)。
(2)该装置补充完整后,仍然存在一定缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
①___________________________________________________________;
②___________________________________________________________。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用__________________________________________;
②写出C中发生反应的化学方程式: _____________________________;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7. 右图是制取和收集某气体的实验装置,该装置可用于 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.已知NH3与CuO在加热条件下可生成N2,方程式为
(1)下面是化学课外小组的同学提出的实验室制备氨气的几种方案:( )
A.硫酸铵固体与消石灰共热
B.浓氨水逐滴加到新制的生石灰中
C.在一定条件下,氮气与氢气化合
D.加热分解氯化铵固体
你认为其中较简单易行的方案有( )(填字母);其反应的化学方程式为:( )
(2)该小组同学设计的制备氮化镁的实验方案如下图(夹持及加热仪器没有画出),且在实验前系统内的空气均已排尽。
(2)该实验完成后,能否得到纯净的氮化镁( )(填“能”或“不能”);简述理由( ) 。
②装置C的作用是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.硫酸亚铁在不同温度下分解的产物不同,可能是FeO和






(l)连接好装置加入药品前应该进行的操作是__________________。
(2)装置Ⅱ的作用是__________和___________,该烧杯中水的温度适宜的是_________(填“


(3)装置Ⅲ中应加入的试剂是___________;证明气体产物中有
A.品红溶液 B.淀粉KI溶液 C. 

(4)装置V中试剂为NaOH溶液,其作用是______________________,反应的离子方程式为________________________________________。
(5)请用化学方法确定反应结束后装置I试管中固体产物的成分,写出实验操作及现象_______________________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析