- 常见金属的活动性顺序及其应用
- 共63题
23.H、C、N、O、Al、S是常见的六种元素。完成下列填空:
(1)碳元素有12C、13C和14C等同位素。在14C原子中,核外存在 对自旋相反的电子。
(2)碳在形成化合物时,其所成化学键以共价键为主,原因是 。
任选上述元素可组成多种四原子的共价化合物,请写出其中含非极性键的一种化合物的电子式
上述元素可组成盐NH4Al(SO4)2。向10 mL 1mol/L NH4Al(SO4)2溶液中滴加1mol/L的NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下。
①NH4Al(SO4)2溶液中所有离子的浓度由大到
小的顺序是( ) ,请解释阳
离子浓度差异的原因 ( )
②写出N点反应的离子方程式 ( )
③若向10 mL1mol/L NH4Al(SO4)2溶液中加入20 mL
1.2 mol/LBa(OH)2溶液,充分反应后,产生沉淀 ( )mol。
正确答案
2
解析
碳原子的基态原子电子排布式
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+、Al3+的水解能力差异、及NH4+、Al3+与OH–反应的先后顺序。
正确答案
碳有四个价电子且原子半径较小,难以通过完全得到或失去电子达到稳定结构。
解析
碳有四个价电子且原子半径较小,难以通过完全得到或失去电子达到稳定结构。
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+ 、Al3+的水解能力差异、及NH4+ 、Al3+与OH–反应的先后顺序。
正确答案
H:O:O:H或H:C︙︙ C:H
解析
四原子的共价化合物且含非极性键:如H2O2、C2H2等。
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+ 、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+、Al3+的水解能力差异、及NH4+、Al3+与OH–反应的先后顺序。
正确答案
①c(SO42-)> c(NH4+)> c(Al3+)> c(H+)> c(OH–),由于碱性:氨水>Al(OH)3,故Al3+的水解程度大于NH4+的水解程度,c(NH4+) > c(Al3+) ;溶液显酸性,是由于NH4+和Al3+水解造成的,因水解程度较小,所以c(NH4+) 、c(Al3+)远大于c(H+) 浓度。
②NH4+ +OH–→NH3∙H2O。
③0.022。
解析
①从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+可知,碱性强弱是:氨水>Al(OH)3,故Al3+的水解程度大于NH4+的水解程度,c(NH4+) > c(Al3+) ;溶液显酸性,是由于NH4+和Al3+水解造成的,因水解程度较小,所以c(NH4+) 、c(Al3+)远大于c(H+)浓度。
②N点时,不论是从图像还是NH4+ 、Al3+与OH–反应的先后顺序得到:NH4+ +OH–→NH3∙H2O。
③依据: NH4Al(SO4)2 + 2Ba(OH)2 → Al(OH)3↓+ NH3∙H2O + 2BaSO4↓
10×10-3L×1mol/L 2×10×10-3L×1mol/L 0.01mol 0.02 mol
又因:Ba(OH)2过量20×10-3×1.2 mol/L-2×10×10-3L×1mol/L=0.004 mol,
即过量n(OH-)=0.008mol.
依据Al(OH)3 + OH- = AlO2-+ 2H2O
0.008 mol 0.008 mol
最终剩余Al(OH)3的物质的量为0.01mol - 0.008 mol = 0.002 mol,
故最后所得沉淀总量是:0.02 mol+0.002 mol= 0.022 mol。
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+ 、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+、Al3+的水解能力差异、及NH4+、Al3+与OH–反应的先后顺序。
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用。已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3。请回答下列问题:
31.在空气中加热CoCO3可得到黑色Co3O4,写出该反应的化学方程式_______________
32.Co3O4与浓盐酸反应能生成黄绿色气体,写出该反应的离子方程式______________。
33.常温下,CoCl2溶液在碱性条件下可以得到粉红色Co(OH)2沉淀。已知当溶液中某离子的浓度≤10-5mol·L-1时,就认为该离子不存在,Ksp[Co(OH)2]=1.0×10-15mol3·L-3。若要使0.1 mol·L-1CoCl2溶液中的Co2+完全沉淀,则溶液pH的控制范围为____________。
34.Co(OH)2具有较显著的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式_________
35.Co(OH)2在空气中加热时,样品质量随温度变化的曲线如下图所示,通过分析计算确定: ①1000℃时,固体的成分为_____________。②取800℃时的产物(其中Co的化合价为+2、+3),用480 mL5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。则该钴氧化物中n(Co2+) :n(Co3+)=__________。
正确答案
6CoCO3+O2 
解析
空气中加热CoCO3可得到黑色Co3O4,可见Co的化合价升高,必有元素化合价的降低做氧化剂,因此能得出该反应物为空气中的氧气,谈的元素化合价不变,因此,方程式的书写配平需考虑得失电子守恒:6CoCO3+O2 
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
正确答案
Co3O4 + 8H+ + 2Cl- ==3Co2+ + Cl2↑ + 4H2O
解析
Co3O4与浓盐酸反应能生成黄绿色气体,则盐酸的Cl- =化合价升高,Co3O4的化合价必须降低:Co3O4 + 8H+ + 2Cl- ==3Co2+ + Cl2↑ + 4H2O
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
正确答案
≥9
解析
根据沉淀完全时离子浓度应该低于1.0×10-5,代入Ksp[Co(OH)2]=1.0×10-15mol3·L-3进行计算可知pH≥9的控制范围为。
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
正确答案
Co(OH)2+2H2O
解析
本题可以类比铝元素的氢氧化铝的电离,Co(OH)2+2H2O
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
正确答案
①CoO ②3∶2
解析
从图像上得知在1000℃时,固体质量不再发生变化,此时样品已经形成为稳定的氧化物CoO,根据产生的氯气所失去的电子数,综合计算是得电子守恒可知n(Co2+) :n(Co3+)=3∶2
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
14.利用海水提取溴和镁的过程如下,下列说法不正确的是
正确答案
解析
A 溴也会被氢氧化钠吸收而损失,所以错误。D提取溴的过程中两次时用到

考查方向
解题思路
逐步分析流程中的各个反应,弄清每一步得到的具体物质
易错点
题目较复杂,不易完全读懂
知识点
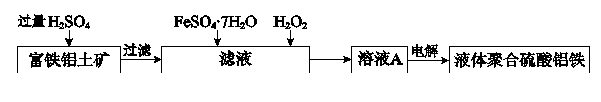
富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略):
24.A12O3与H2SO4发生反应的离子方程式是________。
25.测得滤液中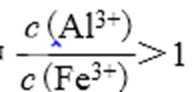
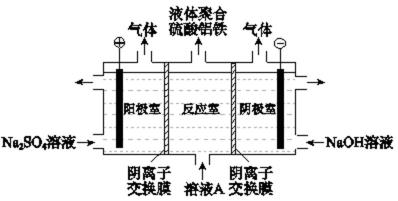
26.将溶液A电解得到液体聚合硫
正确答案
(1)A12O3+6H+=2Al3++3H2O 【考查方向】考查金属元素化合物知识,同时考查读图读表的信息获取能力
解析
(1)A12O3与H2SO4发生反应的离子方程式是A12O3+6H+=2Al3++3H2O
解题思路
分析工业流程中每一步中所发生的反应,进入下一步过程的具体物质,根据题目所给的要求进行电化学放电的分析。,
易错点
题干情景陌生,电极反应物和产物判断错误
正确答案
(2)2Fe2+ + H2O2+2H+ = 2Fe3++2H2O 补充Fe3+
解析
(2)利用这两种物质增大Fe3+浓度,使a=b,2Fe2+ + H2O2+2H+ = 2Fe3++2H2O 补充Fe3+
考查方向
解题思路
分析工业流程中每一步中所发生的反应,进入下一步过程的具体物质,根据题目所给的要求进行电化学放电的分析。,
易错点
题干情景陌生,电极反应物和产物判断错误
正确答案
(3)① 2H++2e-=H2↑ ②减小 ③电解过程中反应室中的SO42-通过阴离子交换膜进入阳极室,阴极室中的OH-通过阴离子交换膜进入反应室,生成聚合硫酸铝铁。【考查方向】考查金属元素化合物知识,同时考查读图读表的信息获取能力
解析
(3)① 阴极清理自放电2H++2e-=H2↑ ②阳极随着氢氧根离子放电 ,pH减小 ③电解过程中反应室中的SO42-通过阴离子交换膜进入阳极室,阴极室中的OH-通过阴离子交换膜进入反应室,生成聚合硫酸铝铁。
解题思路
分析工业流程中每一步中所发生的反应,进入下一步过程的具体物质,根据题目所给的要求进行电化学放电的分析。,
易错点
题干情景陌生,电极反应物和产物判断错误
由软锰矿制备高锰酸钾的主要反应如下:熔融氧化 3MnO2+KClO3+6KOH
37.在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填序号)a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.泥三角
38.在“加酸岐化”时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。反应之后得到高锰酸钾的步骤是:过滤、蒸发结晶、趁热过滤。 该步骤能够得到高锰酸钾的原理是 。
39.采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O
40.草酸钠滴定法测定高锰酸钾的质量分数步骤如下:(已知涉及到的反应:Na2C2O4+H2SO4→H2

正确答案
37.c、d
解析
(37)熔融固体物质需要再坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚、铁棒、坩埚钳、泥三角、酒精灯,故答案为:c d;
考查方向
解题思路
制备实验过程需要考虑原理的科学性、操作的严谨、科学、安全,产物的提纯检验。
易错点
方程式书写、实验评价、实验操作、滴定原理的应用、文字表述的严谨性
正确答案
38.会生成硫酸钾,硫酸钾的溶解度小,不易除去; KMnO4能氧化盐酸;KMnO4和K2CO3的溶解度不同
解析
(38)根据表中数据可知,K2SO4溶解度小,加硫酸时会生成K2SO4,会降低产品的纯度;盐酸具有还原性,会被氧化,降低产品的量,
故不宜用盐酸,故答案为:生成K2SO4溶解度小,会降低产品的纯度;盐酸具有还原性,会被氧化,降低产品的量;
考查方向
解题思路
制备实验过程需要考虑原理的科学性、操作的严谨、科学、安全,产物的提纯检验。
易错点
方程式书写、实验评价、实验操作、滴定原理的应用、文字表述的严谨性
正确答案
39.原子利用率高
解析
(39)与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率,故答案为:K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率
考查方向
解题思路
制备实验过程需要考虑原理的科学性、操作的严谨、科学、安全,产物的提纯检验。
易错点
方程式书写、实验评价、实验操作、滴定原理的应用、文字表述的严谨性
正确答案
40.(1)无色变为紫色且半分钟不褪色;(2)0.700;(3)偏高;(4)Mn2+可能是该反应的催化剂,随着Mn2+的产生,反应速率大大加快
解析
(40)①高锰酸钾与草酸钠发生氧化还原反应,反应的离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;②滴定终点,溶液颜色变化,且半分钟内颜色不变,该反应中当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,故答案为:当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色③加热温度大于90℃,部分草酸发生分解,消耗高锰酸钾溶液的体积减少,会导致测得产品纯度偏高,故答案为:偏高;④反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,故答案为:生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
考查方向
解题思路
制备实验过程需要考虑原理的科学性、操作的严谨、科学、安全,产物的提纯检验。
易错点
方程式书写、实验评价、实验操作、滴定原理的应用、文字表述的严谨性
扫码查看完整答案与解析