- 常用仪器及其使用
- 共81题
2.下列实验过程中的现象及结论均正确且存在因果关系的是()
正确答案
A
解析
A.I-具有还原性,在酸性条件下被氧气氧化:4
B.Na2CO3、NaHCO3都是碳酸的钠盐,属于强碱弱酸盐,由于水解程度:CO32->HCO3-,所以溶液的碱性:Na2CO3>NaHCO3,故向等浓度的两种盐溶液中滴入酚酞试液,溶液的红色Na2CO3> NaHCO3
C.向1mL0.1mol/L的MgCl2溶液中加入2mL0.2mol/L的NaOH溶液,MgCl2+2NaOH= Mg(OH)2↓+2NaCl,反应产生白色沉淀,由于碱过量,向上述试管中加入2滴0.1mol/L的FeCl3溶液,过量的NaOH与FeCl3发生复分解反应:3NaOH+FeCl3=Fe(OH)3↓+3NaCl,不能证明Ksp[Mg(OH)2] > Ksp[Fe(OH)3]
D.石蜡油在碎瓷片的催化作用下发生裂化反应,产生烷烃和不饱和的烯烃,因此可以使溴的四氯化碳溶液颜色褪去,但这不能证明石蜡催化加热反应产物为乙烯。
考查方向
解题思路
A.I-具有还原性,4
B.Na2CO3、NaHCO3都是碳酸的钠盐,由于水解程度:CO32->HCO3-,所以向等浓度的两种盐溶液中滴入酚酞试液,溶液的红色Na2CO3> NaHCO3
C. MgCl2+2NaOH= Mg(OH)2↓+2NaCl,反应产生白色沉淀,过量的NaOH与FeCl3:NaOH+FeCl3=Fe(OH)3↓+3NaCl,不能证明Ksp[Mg(OH)2] > Ksp[Fe(OH)3]
D.石蜡油在碎瓷片的催化作用下产生烷烃和不饱和的烯烃,因此可以使溴的四氯化碳溶液颜色褪去,但这不能证明石蜡催化加热反应产物为乙烯。
易错点
过量的NaOH与FeCl3:NaOH+FeCl3=Fe(OH)3↓+3NaCl,不能证明Ksp[Mg(OH)2] > Ksp[Fe(OH)3]。
知识点
根据题目要求,回答下列问题:
16.某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示。该反应的化学方程式为___________。装置中干燥管的作用是__________,小试管中的试剂为_____________。
17.某芳香烃A的相对分子质量为104,其中碳的质量分数为92.3%。则A的结构简式为_____________。在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为_____________。A与氢气完全加成后产物的一氯代物共有____________种。
正确答案

解析
乙酸乙酯的制备实验需要考虑反应物的挥发性和易溶性会导致倒吸现象,方程式的书写需要抓住官能团并注意结构简式的书写
考查方向
解题思路
把握有机官能团性质以及有机物的基本物理性质,有机物分子式确定的一般方法和计算原理
易错点
有机分子式确定、方程式及其有机结构书写
正确答案


解析
根据题意A分子为芳香烃,确定有机分子只有C、H元素,假设有机分子的分子式为CmHn,根据数据计算可知m:n=1:1,且m=n=8,由于可以形成高分子物质,得出该物质为苯乙烯,加氢后的产物需要考虑谈谈双加的加成和苯环的加成,判断产物中有6种等效氢,因此有6种同分异构体。
考查方向
解题思路
把握有机官能团性质以及有机物的基本物理性质,有机物分子式确定的一般方法和计算原理
易错点
有机分子式确定、方程式及其有机结构书写
【科目】化学
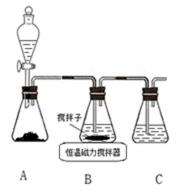
8. CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s) + 3HCl(aq) ⇌ H3CuCl4(aq)。
实验室用下图所示装置制取CuCl,反应原理为:
2Cu2+ + SO2 + 8Cl− + 2H2O == 2CuCl43− + SO42− + 4H+
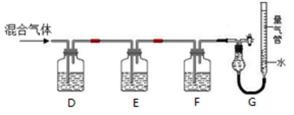
9.某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
已知:i. CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
① D、F洗气瓶中宜盛放的试剂分别是 、 。
② 写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
正确答案
解析
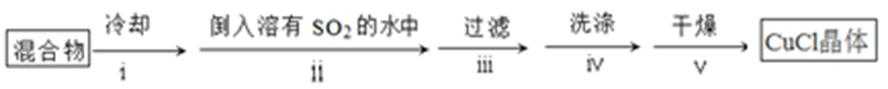
:①A装置准备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气,故答案为:吸收SO2尾气;②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以防止CuCl被氧化;CuCl难溶于水、稀盐酸和乙醇,可以用水、稀盐酸或乙醇洗涤,减小因溶解导致的损失,故答案为:促进CuCl析出、防止CuCl被氧化;水、稀盐酸或乙醇;③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封保存,故答案为:避光、密封;④提纯某混有铜粉的CuCl晶体实验方案:将固体溶于浓盐酸后过滤,去滤液加入大量的水稀释,过滤、洗涤、干燥得到CuCl,故答案为:将固体溶于浓盐酸后过滤,取滤液加入大量水,过滤,洗涤,干燥;
考查方向
解题思路
①A装置准备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气;②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以与溶液中氧气反应;CuCl难溶于水、稀盐酸和乙醇;③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封;④利用浓盐酸溶解CuCl生成H3CuCl4,过滤分离,再用水稀释后过滤分离;
易错点
对实验方案,实验过程,实验原理认识不到位
正确答案
① NaOH溶液(或“KOH溶液”“Ba(OH)2溶液”等其他合理答案) CuCl的盐酸溶液
② 2S2O42−+3O2+4OH− == 4SO42−+2H2O
解析
: ①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积,故答案为:氢氧化钡溶液;CuCl的盐酸溶液;②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水,反应离子方程式为:2S2O42-+3O2+4OH-=4SO42-+2H2O,故答案为:2S2O42-+3O2+4OH-=4SO42-+2H2O.
考查方向
解题思路
①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积;②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水.
易错点
对实验方案,实验过程,实验原理认识不到位
7. 某学习小组按如下实验过程测量海带中碘的含量
上述实验过程对仪器选择不合理的是
正确答案
解析
A、过程Ⅰ固体物质的灼烧应该在坩埚中进行,故A正确;
B、过程Ⅱ进行固液混合物的过滤应该使用过滤装置,注意:一贴二低三靠的原理,故B正确;
C、实验Ⅲ配置一定体积一定浓度的溶液应该在容量瓶中进行一个分液操作,此装置用于互不相溶物质的分离,故C错误;
D、实验Ⅳ进行滴定的试验应该实用滴定管进行试验,故D正确
考查方向
化学实验中的基本操作
解题思路
过程Ⅰ固体物质的灼烧应该在坩埚中进行;过程Ⅱ进行固液混合物的过滤应该使用过滤装置;实验Ⅲ配置一定体积一定浓度的溶液应该在容量瓶中进行;实验Ⅳ进行滴定的试验应该实用滴定管进行试验。
易错点
容量瓶的使用
教师点评
本题考查了实验操作过程,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力,题目较简单。
知识点
某学习小组开展下列实验探究活动:
14.装置A中反应的化学方程式为 。
15.设计实验:利用装置A中产生的气体证明+4价硫具有氧化性 。
16.选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
17.利用G装置可测定装置A残液中SO2的含量。量取1.00 mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2 + H2O2=H2SO4,然后用0.1000 mo1/L-1 NaOH标准溶液进行滴定,至终点时消耗NaOH溶液20.00 mL。
①G中球形冷凝管的冷凝水进口为 (填“a”或“b”)。
②残液中SO2含量为 g.L-1。
③经多次测定发现,测定值始终高于实验值,则其原因是 。
正确答案
CaSO3+2HCl=CaCl2+SO2↑+H2O
解析
盐酸与亚硫酸钙反应生成氯化钙、二氧化硫与水,反应方程式为:CaSO3+2HCl=CaCl2+SO2↑+H2O
考查方向
气体的制备
解题思路
盐酸与亚硫酸钙反应生成氯化钙、二氧化硫与水;
易错点
方程式的书写错误
教师点评
酸与盐的基本反应,题目较简单。
正确答案
将SO2通入氢硫酸溶液或者硫化钠(NaHS也给分)溶液中,出现淡黄色沉淀(或溶液变浑浊)即证。
解析
二氧化硫与氢硫酸反应生成硫,反应中二氧化硫表现氧化性,利用装置A中产生的气体证明+4价硫具有氧化性:将SO2通入氢硫酸溶液中,出现淡黄色沉淀,证明+4价硫具有氧化性
考查方向
考查SO2的氧化性
解题思路
二氧化硫与氢硫酸反应生成硫,反应中二氧化硫表现氧化性
易错点
操作描述易出错
教师点评
考查基本性质反应,较简单。
正确答案
B、E;除去HCl气体;当D中品红不褪色,F中出现白色沉淀。
解析
次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则:装置连接顺序为A、C、B、E、D、F,其中装置C的作用是除去HCl气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸
考查方向
实验方案设计
解题思路
次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中;
易错点
易忽视SO2中HCl的除去
教师点评
借助于亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断,题目难度中等。
正确答案
b;64.00;残液中有剩余的盐酸(或过氧化氢),导致实验中消耗的氢氧化钠的量偏多。
解析
①采取逆流原理通入冷凝水,即球形冷凝管进水口为b,故答案为:b;
②设残液中SO2含量为xg.L-1,则:
SO2~~H2SO4~~2NaOH
64g 2mol
xg.L-1×0.001L 0.02L×0.1mol/L
所以64g:xg.L-1×0.001L=2mol:0.02L×0.1mol/L
解得x=64.00
故答案为:64.00;
③残留液中有剩余的盐酸,挥发出HCl,会消耗NaOH,导致测定值始终高于实际值
考查方向
仪器的使用,含量的测定及其计算
解题思路
①采取逆流原理通入冷凝水;
②根据关系式:SO2~H2SO4~2NaOH计算;
③残留液中有剩余的盐酸
易错点
残留液中含有盐酸
教师点评
考查物质含量测定实验,涉及仪器使用、化学计算
扫码查看完整答案与解析