- 难溶电解质的溶解平衡及沉淀转化的本质
- 共53题
某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
正确答案
解析
b、c两点的金属阳离子的浓度相等,设浓度都为x,c(OH-)c=10-9.6, c(OH-)b=10-12.7 ,则Ksp[Fe(OH)3]=x×(10-12.7)3,Ksp [Cu(OH)2] =x×(10-9.6)2,故Ksp[Fe(OH)3]<Ksp [Cu(OH)2];由a点变到b点,碱性增强,而NH4Cl溶于水后,溶液呈酸性,故B错误;只要温度一定,Kw就一定,C正确;溶度积曲线上的点表示溶液达到饱和,曲线左下方表示不饱和,右上方Q>K,表示沉淀要析出,故D正确。
知识点
我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
正确答案
解析
A、除去硫酸根的同时,引入了新的杂质硫酸根,错误;B、要得到钠和氯气需要电解熔融的

知识点
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100ml溶液A 。②准确量取25.00 ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g 。③准确量取25.00 ml溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 ml。H2O2与KMnO4反应的离子方程式如下:
2MnO4―+5H2O2+6H+=4Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(2)上述滴定不加稀硫酸酸化,MnO4―被还原成MnO2,其离子方程式为:
。
(3)通过计算确定样品的组成(写出计算过程)。
正确答案
见解析。
解析
(1)n(BaSO4)=0.5825g/233 g·mol-1=2.50×10-3 mol
(2)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(3)n(H2O2)=5/2·(0.0200mol· L-1×25.00 mL)/1000mL· L-1=1.25×10-3 mol
m(Na2SO4)=142g·mol-1×2.50×10-3mol=0.355g
m(H2O2)=34g·mol-1×1.25×10-3mol=0.0425g
n(H2O)=[(1.7700g×25.00mL/100 mL)-0.355g-0.0425g]/18 g·mol-1
=2.5×10-3 mol
x:y:z=n(Na2SO4):n(H2O2):n(H2O)=2:1:2
硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O
本题属于物质组成分析与化学综合计算题。利用氧化还原反应滴定进行成分析,运用元素守恒进行推理计算,兼有溶度积常计算,离子方程式书写。
知识点
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,下列说法正确的是
正确答案
解析
A错,银器放在铝制容器中,由于铝的活泼性大于银,故铝为负极,失电子,银为正极,银表面的Ag2S得电子,析出单质银附着在银器的表面,故银器质量增加;
C错,Al2S3在溶液中不能存在,会发生双水解反应生成H2S和Al(OH)3;
D错,黑色褪去是Ag2S转化为Ag而不是AgCl
知识点
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-


其中第①步存在平衡:2CrO42-(黄色)+2H+
(1)若平衡体系的pH=2,该溶液显_______色。
(2)能说明第①步反应达平衡状态的是_______。
a. 222Cr2O72-和222CrO42-的浓度相同
b.2v (Cr2O72-)=v (CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要_______mol的FeSO4
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) 
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH―)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至_______。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生222Cr(OH)3沉淀。
(5)用Fe做电极的原因为_______。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_______,溶液中同时生成的沉淀还有_______。
正确答案
(1)橙
(2)c
(3)6
(4)5
(5)阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
(6)2H++2e-=H2↑;Fe(OH)3
解析
(1) c (H+)增大,平衡2CrO42-(黄色)+2H+
(2)Cr2O72-和CrO42-的浓度相同时,并不能说明各组分的浓度不再改变了,故a不能说明反应已达平衡状态;v(Cr2O72-)和v(CrO42-)可表示正反应或逆反应,2v(Cr2O72-)=v (CrO42-)意义不明,不能说明正逆反应速率相等;溶液的颜色不再改变,也就是各物质的浓度不再改变,是平衡状态,故选c;
(3)还原1 molCr2O72-离子生成2 mol Cr3+,得到的电子数为6 mol,根据电子得失守恒可知,需要6 mol的FeSO4
(4)当c(Cr3+)=10-5 mol/L时,溶液的c(OH―)=
(5)在电解法除铬中,铁作阳极,铁优先失去电子生成Fe2+,以提供还原剂;
(6)在阴极附近溶液pH升高的原因是H+放电生成H2的同时,降低了溶液的酸性;Fe2+与Cr2O72-反应生成了Fe3+,Fe3+转化为Fe(OH)3沉淀。
知识点
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCI溶液等体积混合得到浊液a,过滤得到滤液b和baisechendianc;
② 像滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;
③ 像沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
正确答案
解析
A、绝对不溶的物质没有,难溶物质在溶液中存在沉淀溶解平衡,故正确;
B、溶液中存在沉淀溶解平衡,滤液中含有Ag+,故错误;
C、D选项沉淀由白色变为黄色,说明生成AgI,反应向更难溶的方向进行,故正确。
知识点
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1) 将菱锌矿研磨成粉的目的是_____。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Go
(4)根据下表数据,调节“滤液
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a,大理石粉 b,石灰乳 c,纯碱溶液 d,烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
正确答案
(1)增大反应物接触面积或增大反应速率或使反应更充分
(2)
(3)
(4)
(5)b或(b和d);d
(6)蒸发浓缩、冷却结晶
(7)
解析
(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使反应更加充分。
(2)漂白粉的成分中含有次氯酸根,调节酸碱度后,具有较强的氧化性,能使+2价的铁氧化成+3价,氢氧化亚铁变成氢氧化铁必须增加氢氧元素的量,可以推测出另一种反应物为水,清楚了反应物,一般可以顺利地配平。
(3)化学式量为89,组成元素是



(4)






(5)a大理石粉难溶于水、选择熟石灰和烧碱溶液可以使溶液的碱性增强,有利于镁离子完全沉淀。
(6)蒸发浓缩、冷却结晶能使晶体尽快地析出。
(7)综合计算(不展开)
知识点
下列有关实验操作、现象和解释或结论都正确的是
正确答案
解析
本题综合考查化学实验以及元素化合物的相关知识。
A选项,铁粉过量应该生成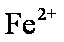
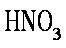
知识点
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
正确答案
解析
本题主要考察溶度积常数的概念和有关计算。对应化学式相似的AgCl和AgI来说Ksp越小Ag+浓度越小,即AgCl>AgI;假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=2.0×10-12,即x3=4.0×10-12,因为AgCl饱和溶液中Ag+的浓度为
知识点
溴酸银( AgBr03)溶解度随温度变化曲线如图所示,下列说法错误的是
正确答案
解析
略
知识点
扫码查看完整答案与解析













