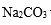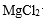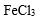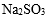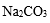- 难溶电解质的溶解平衡及沉淀转化的本质
- 共53题
下述实验不能达到预期实验目的的是
正确答案
解析
略
知识点
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
(1)提出假设
猜想①:白色不溶物可能为___
猜想②:白色不溶物可能为MgCO3
猜想③:白色不溶物可能是碱式碳酸镁
(2)定性实验
(3)定量实验:
称取实验I中所得干燥、纯净的白色不溶物14.2 g,充分加热至不在产生气体为止,并使分解
产生的气体全部通入如下装置中:
①实验测得装置A增重1.8 g,装置B增重4.4 g,则白色不溶物的化学式为_____
②装置C的作用为____,若移除装置C会导致
(4)探究原理
①请结合化学用语和化学平衡移动原理解释Mg与饱和NaHC03溶液反应产生大量气泡和白
色不溶物的原因:_______
②250C时,测得Mg与饱和NaHC03溶液反应所得混合体系的pH为10,则该体系中
为(已知
正确答案
(1)
(2)
(3)
(4)
解析
略
知识点
下列有关实验操作、现象和解释或结论都正确的是
正确答案
解析
略
知识点
欲检验CO2气体中是否含有SO2、HCl,进行如下实验:
①将气体通入酸化的AgNO3溶液中,产生白色沉淀a;
②滤去沉淀a,向滤液中加入Ba(NO3)2溶液,产生白色沉淀b。
下列说法正确的是
正确答案
解析
略
知识点
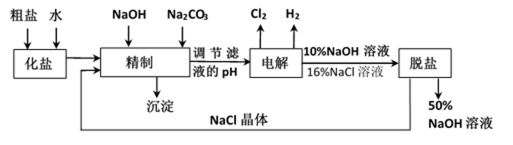
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 。
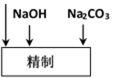
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去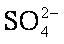
a. Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(4)在实际生产中也可以用BaCO3除去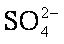
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
正确答案
见解析。
解析
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,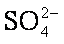

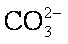
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
知识点
已知:
对于含Fe2(SO4) 3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,下列说法错误的是
正确答案
解析
略。
知识点
根据下列实验现象,所得结论不正确的是
正确答案
解析
略
知识点
下述实验能达到预期目的的是
正确答案
解析
略
知识点
下表中的实验操作能达到实验目的或能得出相应结论的是
正确答案
解析
略
知识点
下列有关现象或反应的原理解释正确的是
正确答案
解析
略。
知识点
扫码查看完整答案与解析