- 钠的化学性质
- 共24题
5.下列实验操作、现象和结论均正确的是 ()
正确答案
解析
因为Cu(OH)2与Mg(OH)2的Ksp表达式相同,加入的Mg观察K的焰色,要透过蓝色钴玻璃,B错误。C实验只能说明酸性HCl>H2SiO3,但比较非金属性看的是最高价的含氧酸的酸性,C错误。蔗糖中加入浓硫酸后,浓硫酸表现出脱水性、强氧化性使蔗糖碳化,并且生成了二氧化碳、二氧化硫气体,D错误。
考查方向
解题思路
要了解实验原理,对实验现象才能更好地解释。例如浓硫酸滴入蔗糖中,蔗糖变黑是被脱水碳化了,产物再与浓硫酸反应产生了刺激性气味的气体,表现了其强氧化性。
易错点
实验原理把握不准,得出错误结论。
知识点
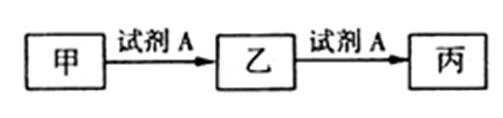
9.已知甲、乙、丙三种物质均含有同种元素X,其转化关系如下:下列说法错误的是
正确答案
解析
A.若甲是CO2,A是NaOH,NaOH不足量产生乙为NaHCO3,NaHCO3与NaOH反应产生Na2CO3,则丙是Na2CO3,故A说法正确;
B.若A为硝酸,则甲为铁,乙为硝酸亚铁,丙为硝酸铁,甲与丙反应可生成乙,故B说法错误;
C.若A为氧气,丙为红棕色气体NO2,则乙为NO气体,甲就为N2,故C说法正确;
D.若乙为NaHCO3,A为氢氧化钠,则甲为二氧化碳,丙可以为碳酸钠,故D说法正确;
考查方向
解题思路
A.若甲是CO2,A是NaOH,NaOH不足量产生乙为NaHCO3,NaHCO3与NaOH反应产生Na2CO3,则丙是Na2CO3;
B.若A为硝酸,则甲为铁,乙为硝酸亚铁,丙为硝酸铁带入验证;
C.若A为氧气,丙为红棕色气体NO2,则甲可能为非金属单质N2
D.若乙为NaHCO3,A为氢氧化钠,则甲为二氧化碳,丙可以为碳酸钠,带入验证
易错点
不能有效提取见物质的性质及相互转化的关系求解,
知识点
亚氯酸钠(NaClO2)是重要漂白剂。已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3利NaCl。某化学探究小组开展如下图所示实验制取NaClO2晶体并测定其纯度。回答下列问题:
8.用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要__________(填仪器名称);右下图中装置C的作用是___________。
9.装置D中反应生成NaClO2的化学方程式为_____________________。
反应后溶液中阴离子除ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有一种阴离子是_______________,检验该离子的方法是__________________。产生该阴离子最可能的原因是_________________________。
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
10.请补充从反应后的溶液中获得NaClO2晶体的操作步骤:①减压,55℃蒸发结晶;
②趁热过滤;③_____________;④_____________;得到成品。
11.如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________。
12.测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量KI晶体,在酸性条件下发生反应:ClO2-+4I-+4H+=2H2O+2I2+Cl-。将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
(已知:I2+2 S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是___________;
②所称取的样晶中NaClO2的物质的量为_________(用含c、V的代数式表示)。
正确答案
量筒
防止D瓶溶液倒吸到B瓶中(或安全瓶)
解析
用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,作为质量分数的溶液,加水的质量可以间接的量取水的体积,故还需要量筒;图中装置C是安全瓶——能起到防止D瓶溶液倒吸到B瓶中的作用。
考查方向
解题思路
依据实验的基本操作方法原理(如仪器的实验、离子的检验、结晶、滴定实验步骤、计算等)解题,特别注意题中温度等信息的利用。
正确答案
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
SO42-
取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-
a
解析
因为装置B中制备所得ClO2经装置C进入装置D中反应,要在低于60℃才能生产出NaClO2,其反应物有:ClO2、H2O2、NaOH,生成物现有NaClO2,依据氧化还原反应规律——氯的化合价降低(+4→+3)、则必有化合价升高的——只能是双氧水中的氧(-1→0),产物之二是氧气,最后依据H、O原子守恒配平出H2O。故该化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2。
反应后溶液中阴离子除ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有一种阴离子:从装置B中生成气体看,还可能有SO2,SO2进入装置D被氧化为SO42-,检验SO42-的方法是:取少量反应后的溶液于一只洁净的试管中,先加足量的稀盐酸酸化,无现象,再加几滴BaCl2溶液,若有产生白色沉淀,则说明含有SO42-。产生该阴离子最可能的原因是浓硫酸与Na2SO3反应生成SO2。
考查方向
解题思路
依据实验的基本操作方法原理(如仪器的实验、离子的检验、结晶、滴定实验步骤、计算等)解题,特别注意题中温度等信息的利用。
易错点
方程式的书写
正确答案
③用38℃~60℃热水洗涤
④低于60℃干燥
解析
请补充从反应后的溶液中获得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;
②趁热过滤;
③用38℃~60℃热水洗涤(因“低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解”);
④低于60℃干燥;得到成品。
考查方向
解题思路
依据实验的基本操作方法原理(如仪器的实验、离子的检验、结晶、滴定实验步骤、计算等)解题,特别注意题中温度等信息的利用。
易错点
实验步骤的完善
正确答案
NaClO3和NaCl
解析
如果撤去D中的冷水浴,可能导致产品中混有的杂质判断依据是:“高于60℃时NaClO2分解成NaClO3利NaCl”,故杂质是NaClO3和NaCl
考查方向
解题思路
依据实验的基本操作方法原理(如仪器的实验、离子的检验、结晶、滴定实验步骤、计算等)解题,特别注意题中温度等信息的利用。
正确答案
①溶液蓝色恰好褪去且半分钟内不复原
②cV•10-3 mol
解析
测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量KI晶体,在酸性条件下发生反应:ClO2-+4I-+4H+=2H2O+2I2+Cl-。将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
(已知:I2+2 S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是:当生成的I2与Na2S2O3恰好完全反应时,淀粉溶液的蓝色就恰好消失。故答:溶液蓝色恰好褪去且半分钟内不复原;
②所称取的样品中NaClO2的物质的量为:由题中两方程式可得计量关系式为NaClO2~2I2~4 S2O32- 有:n(NaClO2)= n(Na2S2O3)/4 = c mol·L-1·10-3V L×100 mL÷25.00 mL÷4= cV•10-3 mol。
考查方向
解题思路
依据实验的基本操作方法原理(如仪器的实验、离子的检验、结晶、滴定实验步骤、计算等)解题,特别注意题中温度等信息的利用。
4.下列试剂不会因为空气中的二氧化碳和水蒸气而变质的是( )
正确答案
解析
A.碳酸钠是盐和二氧化碳、水蒸气都不发生反应,不会因为空气中的二氧化碳和水蒸气而变质,故A正确;
B.过氧化钠和空气中的二氧化碳、水蒸气都发生反应,会因为空气中的二氧化碳和水蒸气而变质,故B错误;
C.氧化钙是碱性氧化物和空气中的水反应生成氢氧化钙,会因为空气中的二氧化碳和水蒸气而变质,故C错误;
D.次氯酸钙会吸收空气中的二氧化碳和水蒸气发生反应生成次氯酸和碳酸钙,会因为空气中的二氧化碳和水蒸气而变质,故D错误;
考查方向
金属化合物的性质
解题思路
不会因为空气中的二氧化碳和水蒸气而变质的是物质和二氧化碳、水蒸气不发生反应的物质,据此分析判断选项
易错点
物质的性质
教师点评
本题考查了一些常见物质在空气中发生反应的问题,难度不大
知识点
4.不能用于比较Na与Al金属性相对强弱的事实是
正确答案
解析
A.对应的最高价氧化物的水化物的碱性越强,金属性越强,可以比较Na与Al金属性相对强弱,故A正确;
B.Na和AlCl3溶液反应,钠与水反应,不能说明Na的金属性比铝强,故B错误;
C.金属单质与水反应越剧烈,金属性越强,比较Na与Al金属性相对强弱,故C正确;
D.比较同浓度NaCl和AlCl3的pH值,AlCl3的pH小,说明铝离子发生了水解,其碱的碱性比Na的弱,所以能比较Na、Al金属性强弱,故D正确
考查方向
金属性强弱判断
解题思路
比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度进行判断
易错点
D项中pH不同说明NaOH和Al(OH)3碱性不同
教师点评
本题考查金属性强弱判断,题目难度不大,金属的金属性强弱与失电子多少无关,与失电子难易程度有关
知识点
扫码查看完整答案与解析