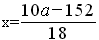- 硫酸亚铁的制备
- 共4题
6.下列实验操作、现象和结论均正确的是 ( )
正确答案
解析
观察K元素的焰色反应要透过蓝色钴玻璃,没有透过蓝色钴玻璃,所以不能确定溶液中是否含有钾离子,故A错误;
B.将SO2和CO2气体分别通入水中至饱和,生成亚硫酸和碳酸,浓度不同,不能利用测定pH比较酸性,故B错误;
C.滴加KSCN溶液未出现血红色,只能说溶于稀盐酸后没有Fe3+,铝热剂里可能含有FeO,所以铝热剂中不能确定是否含有铁的氧化物,故C正确;
D.检验醛基要在碱性条件下进行,向淀粉溶液中加入稀H2SO4,反应后溶液呈酸性,所以要加NaOH中和H2SO4至溶液呈碱性后才可以滴加新制Cu(OH)2悬浊液进行检验。
考查方向
解题思路
A.观察K元素的焰色反应要透过蓝色钴玻璃;
B.SO2和CO2气体的溶解性不同,所以分别通入水中至饱和,生成亚硫酸和碳酸的浓度不同,不能利用测定pH比较酸性;
C.只能说溶于稀盐酸后没有Fe3+,铝热剂里可能含有FeO;
D.检验醛基要在碱性条件下进行,所以滴加新制Cu(OH)2悬浊液前要加NaOH中和H2SO4。
易错点
A.观察K元素的焰色反应要透过蓝色钴玻璃;
B.在相同时才可以通过pH大小比较酸性强弱;
D.检验醛基要在碱性条件下进行,
知识点
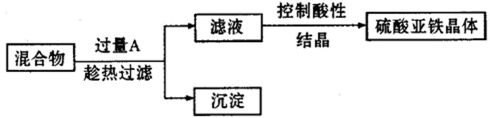
为了保护坏境,充分利用资源。某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(主要以Fe2O3存在,还含有氧化铝.二氧化硅等杂质)转变成重要的化工原料FeSO4(反应条件略)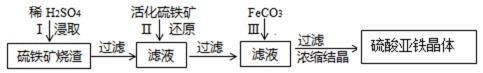
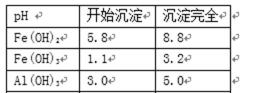
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O15FeSO4+8H2SO4,不考虑其它反应,已知各氢氧化物沉淀PH值, 请回答下列问题:
38.第III步目的是 。
39.检验所得绿矾晶体中是否含有Fe3+的实验操作为___________________________。
40.得到的绿矾晶体用少量冰水洗涤,其目的是: 。
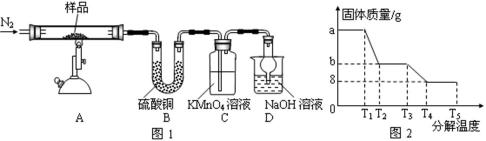
研究性学习小组对硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究:
41.装置B的目的是_____________________;装置C中高锰酸钾溶液褪色,使之褪色的物质的名称是 ;装置D中球形干燥管的作用是_________________。
42.硫酸亚铁晶体完全分解后装置A中残留红棕色固体。写出FeSO4分解的化学方程式 。
43.设计一个简单实验检验产生的含硫元素的气体:_____________________________。
44.某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系如图2,由此得出FeSO4•xH2O中的x值为_____。
正确答案
调剂PH,去除铝杂质(或除去 Al(OH)3 \Fe(OH)3)
解析
第Ⅲ步目的是调剂PH,去除铝杂质(或除去 Al(OH)3\Fe(OH)3)
考查方向
本题考查盐类的水解
解题思路
由流程可知,硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体,以此解答
易错点
盐类水解原理的应用,通过调节pH,让溶液中的某些杂质离子通过水解形成沉淀而除去
教师点评
本题考查盐类的水解,是高考中的重要考点,常在涉及金属元素的分离提纯中考查
正确答案
取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,(或滴加苯酚溶液,不出现紫色)表明不含有Fe3+;反之,则然;
解析
检验所得绿矾晶体中是否含有Fe3+的实验操作为取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,(或滴加苯酚溶液,不出现紫色)表明不含有Fe3+;反之,则含
考查方向
本题考查Fe3+的检验操作
解题思路
由流程可知,硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体,以此解答
易错点
离子检验中的操作规范,对于晶体一定要取样溶解后滴加试剂,然后是现象及结论;若是溶液鉴别就需要取少量溶液与试管中,然后滴加试剂,现象及结论
教师点评
本题考查Fe3+的检验操作,是中学化学中的重要金属离子的检验,要求熟练掌握
正确答案
①除去晶体表面附着的硫酸等杂质;② 温度低.用水少降低洗涤过程中硫酸亚铁晶体的损耗。
解析
得到的绿矾晶体用少量冰水洗涤,其目的是①除去晶体表面附着的硫酸等杂质,②温度低、用水少降低洗涤过程中硫酸亚铁晶体的损耗
考查方向
本题考查沉淀的洗涤
解题思路
由流程可知,硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体,以此解答
易错点
沉淀洗涤时需要注意的事项:洗涤试剂既能将沉淀物表面的杂质离子洗去,还不能溶解掉沉淀物
教师点评
本题考查沉淀的洗涤,属于基本实验操作,是高考中的重要考查内容,常在化工流程题中考查
正确答案
检验产物水生成; 二氧化硫 ; 防止氢氧化钠溶液倒吸;
解析
装置B的目的是检验产物水生成;装置C中高锰酸钾溶液褪色,使之褪色的物质的名称是二氧化硫;装置D中球形干燥管的作用是防止氢氧化钠溶液倒吸
考查方向
本题考查物质的组成
解题思路
对硫酸亚铁晶体热分解研究,根据晶体中所含元素推断其产物为铁的氧化物、硫的氧化物、水,以此来解答
易错点
各部分装置的作用,根据试剂推断其作用
教师点评
本题考查物质的组成,为近几年高考出现频率较高的题目,题目难度中等
正确答案
2FeSO4
解析
固体红棕色,应为Fe2O3,据氧化还原知识的FeSO4分解的化学方程式为2FeSO4
考查方向
本题考查化学方程式的书写,涉及氧化还原知识
解题思路
固体为红棕色,应为氧化铁,据氧化还原知识分析解答
易错点
氧化还原的分析,从化合价入手分析,找出升降的元素
教师点评
本题考查化学方程式的书写,是高考中的必考内容,常与氧化还原的知识交织考查
正确答案
或流程图或文字描述,只要合理均给分(用盐酸酸化的氯化钡溶液与品红溶液,如分别通入可不分先后;如按流程进行,氯化钡在前品红在后)。
解析
分解后含硫元素的气体为SO2和SO3,SO2能使品红溶液褪色而SO3不能,SO3通入到盐酸酸化的氯化钡溶液中可形成沉淀,而SO2没有
考查方向
本题考查物质的鉴别
解题思路
分解后含硫元素的气体为SO2和SO3,根据二者的性质选择试剂鉴别
易错点
SO2和SO3的性质差异,注意它们的一些特性反应
教师点评
本题考查物质的鉴别,属于重要化合物的鉴别,是高考中的常考内容,题目难度中等
正确答案
(10a-152)/18
解析
通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:2x,
Fe2O3~2FeSO4.xH2O
160 2×(152+18x)
8g a
解得
考查方向
本题考查物质的含量测定
解题思路
根据硫酸亚铁晶体和氧化铁中的铁元素守恒列关系式求解
易错点
关系式中的比例关系,常依据某种元素的守恒得到相应关系
教师点评
本题考查物质的含量测定,为高频考点,题目难度中等
28.铁是人体必须的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。
(1)某同学以市售铁屑(含少量氧化铜、氧化铁等杂质)为原料制备纯净绿矾晶体。实验步骤设计为:
①取一定量的铁屑于烧杯,加入过量稀硫酸溶解。若该操作需用90 mL 1 mol/L的硫酸溶液,则配制时用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有两种仪器分别是 ( )。
②再向上述溶液中加入过量的铁粉,让其充分反应,然后过滤,再从滤液中通过操作a得到晶体,再用少量冰水洗涤获得纯净的绿矾晶体。操作a的操作顺序依次为: ( )、冷却结晶、 ( )。得到的绿矾晶体再用少量冰水洗涤的目的是:除去晶体表面附着的硫酸等杂质; ( )。
(2)制得的绿矾晶体由于保存不妥,容易被氧化。某同学想了解其是否被氧化。请你设计实验证明绿矾晶体部分被氧化。(要求写出实验的步骤、现象、结论)。
(3)下图是某同学利用手持技术,获得8.34 g FeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
①试确定78℃时固体物质M的化学式: ( )。
②取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种红棕色的物质Q,同时有两种无色气体生成且两种气体的组成元素相同,摩尔质量相差16,写出该反应的化学方程式 ( ) 。
③该同学用下图所示装置设计实验,验证②中生成的气态物质。
I. 按气流方向连接各仪器,用字母表示接口的连接顺序:c→ ( )
II. 试剂X的名称是 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
30. I.某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
请根据题目要求回答下列问题:
(1)趁热过滤的目的是( ) 。
(2)结晶操作过程中应控制滤液酸性的原因是( ) ,结晶析出晶体后,用____的方法从溶液中得到晶体。
(3)实验室利用硫酸亚铁溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出该反应的离子方程式( ) 。
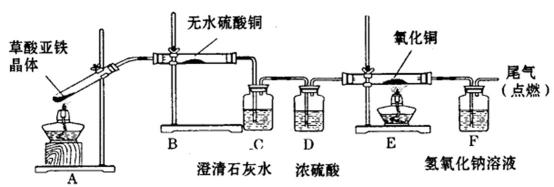
Ⅱ.草酸亚铁晶体(FeC2O2·2H2O,相对分子质量180)受热易分解,某课外小组设计如下图的实验装置来检验其分解产物。
(4)该装置中明显不合理的部分是( ) (填字母),原因是( ) 。
(5)写出B、C处的现象( ) 。
(6)当72.0g FeC2O4·2H2O完全反应后,残留固体混合物质量为27.2g,无水硫酸铜增重14. 4g,C装置增重22.Og。求残留混合物的成分和物质的量 ( ) 。(假设每个实验装置的药品足量,气体被充分吸收)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析