- 有关混合物反应的计算
- 共90题
过氧化钠是一种淡黄色固体,有漂白性,能与水、酸性氧化物和酸反应。
54.一定条件下,m克的H2、CO的混合气体在足量的氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重 克。
55.常温下,将14.0克的Na2O和Na2O2的混合物放入水中,得到400 mL pH=14的溶液,则产生的气体标准状况下体积为 L。
56.在200mLAl2(SO4)3和MgSO4的混合液中,加入一定量的Na2O2充分反应,至沉淀质量不再减少时,测得沉淀质量为5.8克。此时生成标准状况下气体体积为5.6 L。
则原混合液中c (SO42-)= mol/L。
57.取17.88 g NaHCO3 和 Na2O2 的固体混合物,在密闭容器中加热到 250 ℃,经充分反应后排出气体,冷却后称得固体质量为15.92 g。请列式计算:
①求原混合物中Na2O2的质量
②若要将反应后的固体反应完,需要1mol/L盐酸的体积为多少毫升?
正确答案
m
解析
CO和H2的混合气体燃烧的方程式:2CO+O2

考查方向
本题考查利用化学方程式的计算
解题思路
利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应;2CO+O2
2H2+O2
易错点
差量法的应用,找准固体物质,分析差量
教师点评
本题考查利用化学方程式的计算,为近几年高考中的重要考查内容,难度中等
正确答案
1.12L
解析
设14.0g混合物中含有氧化钠xmol,含有过氧化钠ymol,则①62x+78y=14,最后得到的溶质为NaOH,得到400mL pH=14的溶液,氢氧化钠的物质的量为:0.4×1=0.4mol,根据钠原子守恒可得:②2x+2y=0.4,联合①②解得:x=0.1、y=0.1,所以0.1mol的过氧化钠生成0.05mol的氧气,标况下生成的氧气的体积为:V(O2)=22.4L/mol×0.05mol=1.12L
考查方向
本题考查混合物的计算
解题思路
氧化钠、过氧化钠与水反应后的溶质为氢氧化钠,根据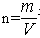
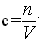
易错点
氧化钠与过氧化钠的化学性质
教师点评
本题考查混合物的计算,涉及pH的计算,题目难度中等
正确答案
2
解析
生成标准状况下气体体积为5.6L,其物质的量为0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:0.3+0.1=0.4mol,则浓度为2mol/L
考查方向
本题考查溶液中的离子反应及其计算
解题思路
据生成的气体的体积可得到过氧化钠与水反应后生成的NaOH的物质的量,至沉淀质量不再减少时,沉淀为氢氧化镁,根据其质量可得到镁离子结合的氢氧根离子的物质的量,从而得到与铝离子反应的氢氧根离子的物质的量,就算出硫酸根离子的物质的量,得其浓度
易错点
熟知溶液中的各离子反应是求解的关键,熟知反应的量的关系
教师点评
本题考查溶液中的离子反应及其计算,是高考重点考查内容,题目难度中等
正确答案
7.8克 (3分) 200mL≤V≤320mL(3分)
解析
①设Na2O2 和NaHCO3的物质的量分别为x,y
2Na2O2+4NaHCO3=4Na2CO3+2H2O↑+O2↑
492 424
17.88 15.41
2Na2O2+2NaHCO3=2Na2CO3+2NaOH+O2↑
324 292
17.88 16.11
15.41<15.92<16.11 说明两个反应都发生
所以78x+84y=17.88 106y+(2x-y)×40=15.92
解之得:x=0.1mol、y=0.12mol
所以m(Na2O2)=7.8g,
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,当反应后溶质为NaCl、NaHCO3时,则需盐酸体积为200mL;当反应后溶质只有NaCl时,则需盐酸体积为320mL
所以盐酸体积为200mL≤V≤320mL,
考查方向
本题考查混合物的计算
解题思路
①设Na2O2 和NaHCO3的物质的量分别为x,y
2Na2O2+4NaHCO3=4Na2CO3+2H2O↑+O2↑
492 424
17.88 15.41
2Na2O2+2NaHCO3=2Na2CO3+2NaOH+O2↑
324 292
17.88 16.11
15.41<15.92<16.11 说明两个反应都发生
所以78x+84y=17.88 106y+(2x-y)×40=15.92
解之得:x=0.1mol、y=0.12mol
所以m(Na2O2)=7.8g,
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,当反应后溶质为NaCl、NaHCO3时,则需盐酸体积为200mL;当反应后溶质只有NaCl时,则需盐酸体积为320mL
易错点
物质的化学性质是分析题目的关键
教师点评
本题考查混合物的计算,题目难度中等,熟知物质的化学性质是解题的关键,注重培养学生的化学计算能力
20.向100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol/L的盐酸, 测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图 所示。下列说法正确的是
正确答案
解析
Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸.
首先,发生反应AlO2-+H++H2O═Al(OH)3↓,最左边曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol.
第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,ab线表示CO32-,bc线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol.
第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,cd线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+).
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,de线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为0.15mol/1mol/L=0.15L=150mL
A.由上述分析可知,原混合溶液中的CO32-与AlO2-的物质的量之比为0.05mol:0.05mol=1:1,故A正确;
B.a点溶液中,溶质为Na2CO3,由质子守恒可知:c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),故B错误;
C.b点碳酸钠和碳酸氢钠的浓度相等,加入了75mL盐酸,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-),故C正确;
D.d→e的过程中铝离子的浓度逐渐增大,铝离子水解促进了水的电离,则该段水的电离程度逐渐增大,故D错误
考查方向
离子浓度
解题思路
Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸.
首先,发生反应AlO2-+H++H2O═Al(OH)3↓,最左边曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol.
第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,ab线表示CO32-,bc线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol.
第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,cd线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+).
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,de线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为0.15mol/1mol/L=0.15L=150mL.据此结合选项解答
易错点
由图像得出先反应的离子为AlO2-
教师点评
本题考查了离子浓度大小比较,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法,试题培养了学生的分析、理解能力及灵活应用能力
知识点
6. 实验:① 0.005 mol·L-1 FeCl3溶液和0.015 mol·L-1 KSCN溶液各1 mL混合得到红色溶液 a,均分溶液a置于b、c两支试管中; ② 向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;③ 再向上述b溶液中滴加3滴1 mol·L-1 NaOH溶液,溶液颜色变浅且出现浑浊; ④ 向c中逐渐滴加1mol·L-1 KSCN
下列分析不正确的是
正确答案
解析
A、根据反应Fe3++3SCN-⇌Fe(SCN)3,增大Fe3+浓度,平衡正向移动,故A正确;
B、上述b溶液中滴加NaOH溶液,三价铁与氢氧根离子反应生成氢氧化铁沉淀,反应为Fe3++3OH-═Fe(OH)3↓,故B正确;
C、实验③中使平衡逆向移动,生成氢氧化铁沉淀,红色变浅,实验④使平衡正向移动,后继续加溶液相当于稀释,红色变浅,原因不同,故C错误;
D、根据上述分析,实验②、③、④均可说明浓度改变对平衡移动的影响,故D正确
考查方向
化学平衡
解题思路
A、根据反应Fe3++3SCN-⇌Fe(SCN)3,增大Fe3+浓度,平衡正向移动;
B、上述b溶液中滴加NaOH溶液,三价铁与氢氧根离子反应生成氢氧化铁沉淀,反应为Fe3++3OH-═Fe(OH)3;
C、实验③中使平衡逆向移动,生成氢氧化铁沉淀,红色变浅,实验④使平衡正向移动,后继续加溶液相当于稀释,红色变浅,原因不同;
D、根据上述分析,实验②、③、④均可说明浓度改变对平衡移动的影响
易错点
实验 ④ 的溶液颜色变化原因
教师点评
本题考查了化学平衡移动基本原理,分析浓度对平衡移动的影响,属于基础知识,难度不大,要求学生能根据反应原理判断实验现象
知识点
14.有一种粉末它是由铁的氧化物中的一种或者两种组成,取3.04 g粉末加热,同时通入足量的CO使之完全反应,再用过量澄清石灰水把生成的气体充分吸收,产生沉淀5g。 则该粉末的组成是( )
正确答案
解析
澄清石灰水将生成的气体充分吸收,产生沉淀5g为碳酸钙的质量,物质的量为

令FeO和Fe3O4混的物质的量分别为xmol、ymol,则根据铁原子和氧原子守恒: 
故选D.
考查方向
解题思路
设铁的氧化物化学式为FexOy,发生反应FexOy+yCO=xFe+yCO2,可知氧化物中氧原子的物质的量等于二氧化碳的物质的量,澄清石灰水将生成的气体充分吸收,产生沉淀5g为碳酸钙的质量,根据
易错点
判断氧化物中氧原子的物质的量等于二氧化碳的物质的量是解题的关键
知识点
10.向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
正确答案
解析
Na2CO3、NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-减少,第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-减少,此阶段Al(OH)3不参与反应,
A.Na2CO3,NaAlO2的混合溶液中加入HCl溶液,先发生反应:AlO2-+H++H2O═Al(OH)3↓,故A正确;
B.第二阶段,AlO2-反应完毕,发生反应:CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,所以b和c曲线表示的离子反应是相同的,故B正确;
C.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO32-反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g,故C正确;
D.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO32-+H+═HCO3-,可知CO32-与AlO2-的物质的量之比为1:1,但这两种物质都是强碱弱酸盐都能水解,水解程度不同导致无法判断溶液中CO32-与AlO2-的物质的量之比,故D错误;
故选D.
考查方向
解题思路
Na2CO3、NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-减少,第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-减少,此阶段Al(OH)3不参与反应,
A.Na2CO3,NaAlO2的混合溶液中加入HCl溶液,先发生反应:AlO2-+H++H2O═Al(OH)3↓
B.第二阶段,AlO2-反应完毕,发生反应:CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,所以b和c曲线表示的离子反应是相同的
C.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO32-反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g
D.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO32-+H+═HCO3-,可知CO32-与AlO2-的物质的量之比为1:1,但这两种物质都是强碱弱酸盐都能水解,水解程度不同导致无法判断溶液中CO32-与AlO2-的物质的量之比
易错点
图中所给信息不能转化为有用的已知条件
知识点
扫码查看完整答案与解析


