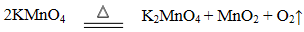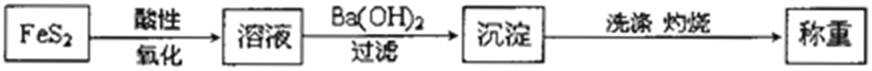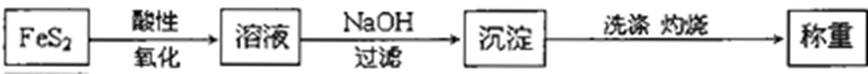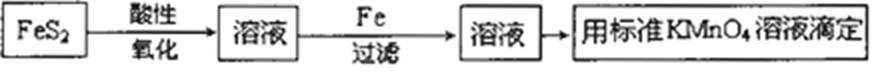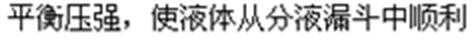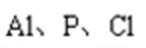- 化学实验方案的评价
- 共19题
某课外小组同学用下图所示装置在实验室制备氯气并探究其相关性质(夹持设备已略)。
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的离子反应方程式为:
____________________________________________________________________;
(2)装置B的作用之一是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象________________________________________;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中①、②、③依次放入_______;(选填字母)
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性大于溴;之后打开活塞,将装置D中少量溶液加入装置E中,振荡;观察到的现象是____________,则说明溴的非金属性大于碘;
(5)有同学提出该实验方案仍有不足,请说明其中两点不足及原因是:
① ;
② 。
正确答案
见解析。
解析
(1)

(2)B中长颈漏斗中液面明显上升,形成水柱;
(3)d ;
(4)黄(或橙); 溶液变蓝色;
(5)①E处未能排除D中过量Cl2的干扰,而置换出I2 ;
②Cl2通入NaHSO3溶液中会产生SO2,污染空气。
(或:C、D装置之间无干燥装置,③处布条不干燥,也可褪色。)
知识点
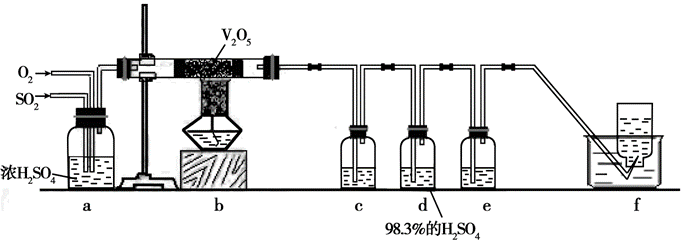
某课外小组欲探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的
成分。已知:① 沸点:SO2 -10℃,SO3 45℃;② SO3遇水剧烈反应,放出大量热,
产生酸雾。③ 98.3% H2SO4可以吸收SO3和酸雾。
提供的药品:Na2SO3固体、10 mol/L H2SO4、催化剂(V2O5)、KMnO4固体、蒸馏水、0.5 mol/L BaCl2溶液、98.3% H2SO4、2.0 mol/L NaOH溶液、品红溶液等。
(1)该小组同学用Na2SO3固体与10 mol/L H2SO4混合制取SO2。发生装置应该选用下图中 装置(填字母)。
(2)若选用上图中b装置制O2,反应的方程式是 。
(3)该小组同学为检验反应后混合气体的成分,设计如下装置:
① b中发生反应的化学方程式是 。
② c中盛放的试剂是 ;e中盛放的试剂是 ,其作用是 。
③ 某同学提出用饱和的NaHSO3溶液代替98.3%的浓 H2SO4,请你评价该方案是否可行,若可以不必说明理由;若不可行,简述其理由 。
正确答案
见解析。
解析
(1) c
(2)
(3)①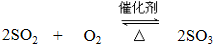
② 0.5 mol/L BaCl2溶液
品红溶液(或KMnO4溶液)
检验和除去SO2气体
③ 虽然饱和NaHSO3溶液可除去SO3,但是SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验。
知识点
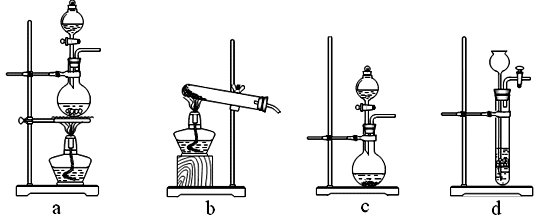
10.分析硫铁矿中FeS2的含量(不考虑杂质的反应,所加试剂均足量),某研究性小组设计了如下四种实验方案,不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。
相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
请回答下列问题:
(1)仪器e的名称为______,装置A中f管的作用是______,其中发生反应的离子方程式为 ______________________。
(2)装置B中的试剂是________________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
(4)在上述(3)的评价基础上,请设计一个合理方案:___________________________。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是__________(填写元素符号)。
正确答案



(3)
(4)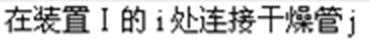
解析
解析已在路上飞奔,马上就到!
知识点
12.下列实验设计方法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析