- 硫化氢
- 共8题
16. 研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____________。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
①质子的流动方向为___________(“从A到B”或“从B到A”)。
②负极的电极反应式为______________________ 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
①用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是______________________。
②若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是___________。
正确答案
(1)SO2 + H2O 

(2)H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH = -806.39 kJ·mol-1
(3)①从A到B ② SO2 – 2e- + 2H2O == SO42- + 4H+
(4)① H2O + 2SO2 + CO32- == 2HSO3- + CO2↑ ② NaOH [多写Ca(OH)2不扣分]
解析
(1)高湿条件下SO2转化为HSO3-的过程即为SO2与水反应生成H2SO3;SO2 + H2O 

由两步反应的能量变化示意可以看出,H2S先被氧化为S(g)释放能量,H2S(g)+0.5O2(g)===S(g)+H2O(g) ΔH = -221.19 kJ·mol-1,然后再S被进一步氧化为 SO42-(aq)释放能量:S(g)+1.5O2(g)+H2O(g)===SO42-(aq) + 2H+(aq) ΔH = -585.20 kJ·mol-1,所以1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式就可以根据盖斯定律完成;将两个热方程式相加:H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH = -806.39 kJ·mol-1
(3)①由于该装置为原电池,且SO2为还原剂失去电子作负极,O2氧化剂得到电子作正极,而质子带正电荷,在原电池中带正电荷的阳离子向正极移动;所以质子的流动方向为从A到B;②由于SO2作负极失去电子,在溶液中一定会生成SO42-,即电极反应式为: SO2 – 2e- + 2H2O == SO42- + 4H+
(4)①由于H2SO3酸性比H2CO3酸性强,所以用纯碱溶液吸收SO2,H2SO3可以将纯碱转化为 CO2, 反应的离子方程式为:H2O + 2SO2 + CO32- == 2HSO3- + CO2↑;②若石灰乳过量,则其产物中有生成的NaOH ,所以再排回吸收池,其中可用于吸收SO2的物质的物质就为NaOH 。
考查方向
通过大气中含硫化合物的转化过程,考查弱电解质的电离平衡、热方程式的书写、电极反应、离子方程式的书写、尾气的处理等中学化学主干知识。
解题思路
(1)高湿条件下SO2转化为HSO3-的过程即为SO2与水反应生成H2SO3,然后再发生电离;
由两步反应的能量变化示意可以看出,H2S(g)先被氧化为S(g)释放能量,
(2)然后再被进一步氧化为 SO42-(aq)释放能量,所以1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式就可以根据盖斯定律完成;
(3)由于该装置为原电池,且SO2为还原剂失去电子作负极,O2氧化剂得到电子作正极,而质子带正电荷,在原电池中带正电荷的阳离子向正极移动;由于SO2作负极失去电子,在溶液中一定会生成SO42-
(4)由于H2SO3酸性比H2CO3酸性强,所以用纯碱溶液吸收SO2,H2SO3可以将纯碱转化为 CO2,若石灰乳过量,则其产物中有生成的NaOH ,所以再排回吸收池,其中可用于吸收SO2的物质的物质就为NaOH。
易错点
多元弱酸的分步电离;书写热方程式要注意物质状态以及焓变值要与系数对应;电极反应、离子方程式的书写都要遵循守恒规律。
知识点
12.与氢硫酸反应有沉淀生成的电解质是( )
正确答案
解析
电解质是在水溶液中或熔融状态下能导电的化合物,包括酸、碱、盐、金属氧化物和水.
CuS不溶于水也不溶于酸,故CuSO4能和H2S反应生成CuS沉淀: CuSO4+H2S=CuS↓+H2SO4,且硫酸铜为电解质,故A正确;
H2S和NaOH发生酸碱中和反应:H2S+2NaOH=Na2S+H2O,无沉淀生成,故B错误;
FeS不溶于水但溶于酸,故FeSO4和H2S不能反应,故C错误;
SO2和H2S发生归中反应有硫单质生成:SO2+2H2S=3S↓+2H2O,但二氧化硫不是电解质,故D错误.
故选A.
考查方向
解题思路
CuS不溶于酸; H2S和NaOH发生酸碱中和反应;FeS不溶于水但溶于酸;
SO2和H2S发生归中反应.
易错点
本题考查了电解质的概念以及复分解反应发生的条件,难度不大,应注意的是FeS不溶于水但溶于酸,故FeSO4和H2S不能反应.
知识点
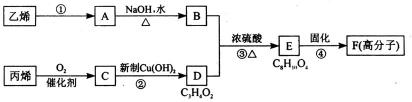
17.以石化产品乙烯、丙烯为原料合成厌氧胶的流程如下。
关于该过程的相关叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析