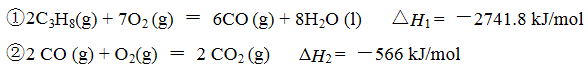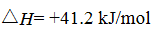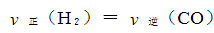- 离子浓度大小的比较
- 共173题
HA为酸性略强与醋酸的一元弱酸。在0.1mol·L-1NaA溶液中,离子浓度关系正确的是
正确答案
解析
略
知识点
下列叙述不正确的是( )
正确答案
解析
A项的命题意图是考查溶液电中性,但忽视了H2PO4-的存在,错误;B项中醋酸过量,混合后溶液呈酸性,正确;碱和酸均抑制水的电离,而可水解的盐则促进水的电离,C项正确;D项中因Ag+和氨水可形成络离子而使AgCl的溶解平衡右移,故AgCl在氨水中溶解度增大,正确。
知识点
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:
(1)反应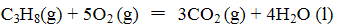

(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.
c.混合气体的平均相对分子质,量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO则平衡常数____(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导
O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为
。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
正确答案
见解析。
解析
(1) -2219.9 kJ/mol
(2) ① bd ②0.16mol/(L·min) ③不变
(3) 正、负
C3H8 + 10O2- - 20e- =3CO2↑+ 4H2O
(4) 有大量无色气泡(或气体)产生,并且有白色沉淀产生
知识点
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时:
①HF(aq) + OH—(aq) == F—(aq) + H2O(l) △H = - 67.7 kJ•mol-1
②H+ (aq) + OH—(aq) == H2O(l) △H = - 57.3 kJ•mol-1
在20 mL 0. 1 mol•L-1氢氟酸中加入V mL 0. 1 mol•L-1NaOH溶液。下列有关说法正确的是
正确答案
解析
本题考查盖斯定律的应用、酸碱中和反应及溶液中离子浓度大小的比较,旨在考查考生对所学生所学知识的整合及应用能力。。
根据盖斯定律,将①式减去②式经整理可得:
HF(aq) 
由反应①放热比反应②多,亦可判断氢氟酸的电离为放热,本题要求突破“弱电解质电离都是吸热”的思维定势。故A选项错误。
当V=20时,两者恰好完全反应生成NaF,溶液中存在质子守恒关系:
c(OH-) = c(HF)+c(H+)
质子守恒式有两种方法推得:
(1)直接推得:因F-水解结合H2O电离出的H+生成HF并提供与HF等量的OH—,且H2O本身电离出H+和OH—;
(2)由NaF溶液的电荷守恒式和物料守恒式求得:NaF溶液的电荷守恒式:
c(Na+) + c(H+) = c(F-) + c(OH-)
NaF溶液的物料守恒式:c(Na+) = c(HF) + c(F-)
消去2个式子中的c(Na+)可得出其质子守恒式 。
因F-水解,故溶液中存在:c(F-)<c(Na+) = 0.05 mol•L-1 ,故B选项正确,C选项错误。
D选项:溶液中离子浓度的大小取决于V的大小,离子浓度大小关系可能为c(F-)>c(H+)>c(Na+)>c(OH-)或c(F-)>c(Na+)>c(H+)>c(OH-)或c(Na+) = c(F-)>c(OH-) = c(H+)或c(Na+)>c(F-)>c(OH-)>c(H+),故D选项错误。
为了更清晰明确D选项的问题,不妨进行如下分析:
影响溶液中各离子浓度的因素有2个:(1)离子的物质的量;(2)溶液的体积。
根据这2个因素的影响,可绘制出下图:
根据上图,并结合离子的变化,可以得到下表离子浓度的大小比较:
知识点
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析