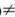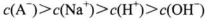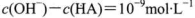- 离子浓度大小的比较
- 共173题
12. 下列叙述正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11. 常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11. 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液 的pH如下表:
下列对混合后溶液的有关说法中,不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。现将0.04mol·L-1HA溶液和0.02mol·L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该溶液显碱性,则溶液中c(CN—)( )c(Na+)(填“<”、“=”或“>”),你得出该结论的依据是 ( )。
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是
(2)二氧化氯(ClO2)为一种黄绿色气体,
①右图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:( )。
②电解一段时间,当阴极产生的气体体积为336 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为( )mol;用平衡移动原理解释阴极区pH增大的原因( )。
(3)25℃时,2.0×10-3 mol·L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F—)与溶液pH的变化关系如图。若将4.0×10-4 mol·L-1CaCl2溶液与4.0×10-3 mol·L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出。[已知Ksp(CaF2):1.5×10-10]( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.研究SO2,CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO32-):n(HSO3-)变化关系如下表:
(1)由上表判断NaHSO3水溶液显 性,原因是:( ) ;
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是 ( ) 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(3)若某溶液中含3mol Na2SO3,逐滴滴入一定量稀HCl,恰好使溶液中Cl-与HSO3-物质
的量之比为2:l,则滴入盐酸中n(HCl)为 ( ) mol;
Ⅱ.CO可用于合成甲醇,反应原理为:CO(g)+2H2(g) 
(1)在容积为2L的密闭容器中通入0.2mol CO(g),0.4mol H2,达到平衡时,CO转化率为50%,则该温度下的平衡常数为 ( ),再加入1.0mol CO后,重新达到平衡,CO的转化率 ( ) (填“增大”,“不变”或“减小”);平衡体系中CH3OH的体积分数 ( )(填“增大”,“不变”或“减小”);
(2)已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g);H2(g)+
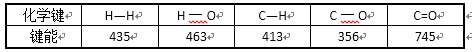
有关键能数据如下:(单位:kJ/mo1)
写出甲醇气体完全燃烧生成气态水的热化学方程式:( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析